1、填空题 (6分)在新疆和青海交界处有一狭长山谷。有时风和日丽的晴天顷刻间电闪雷鸣,狂风大作,人畜往往遭雷击到下。奇怪的是这里的牧草茂盛,四季常青,被当地牧民称为“魔鬼谷”。请用化学方程式表示“魔鬼谷”牧草茂盛,四季常青的原因?、
??、?
2、选择题 下列有关化学反应过程或实验现象的叙述中,正确的是(?)
A.氨气的水溶液可以导电,说明氨气是电解质
B.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的
C.在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液,溶液的红色逐渐褪去
D.氯气可以使湿润的有色布条褪色,说明氯气具有漂白作用
3、填空题 某化学小组对SO2与漂白粉的反应进行实验探究,实验过程如下:取10克漂白粉固体,加入250mL水中,部分固体溶解溶液略有颜色,过滤后用洁净的玻璃棒沾取滤液到pH试纸上,发现pH试纸先变蓝(约为12)后褪色.回答下列问题:
(1)工业制取漂白粉的化学方程式是? __?,漂白粉在空气中变质的原因?(用化学反应方程式说明)
(2)pH试纸颜色的变化说明漂白粉溶液具有的性质是?,ClO2和漂白粉一样也具有强氧化性,其消毒效率(以单位物质的量得电子的数目表示)是Cl2的?倍;
(3)将SO2持续通入漂白粉溶液中,发现澄清透明的溶液先变为黄绿色,随后溶液中产生大量白色沉淀且黄绿色褪去。回答下列问题:
①澄清透明溶液变为黄绿色的可能原因是:随溶液酸性的增强,漂白粉的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是?;
②用离子方程式解释现象中黄绿色褪去的原因:?;
③SO2与漂白粉的有效成分在酸性条件下反应的离子方程式:?。
4、实验题 (16分)某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾 气进行吸收处理。
气进行吸收处理。
(1)请写出MnO2和浓盐酸制备Cl2的离子方程式________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO 4+H2O中的还原剂为_______________
4+H2O中的还原剂为_______________ _.
_.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl 、OH
、OH 和SO
和SO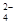 .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①?提出合理假设.
假设1:只存在SO32-;假设2:既不存在SO3 2-也不存在ClO
2-也不存在ClO ;
;
假设3:_____________.假设4:?
②?设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3moL L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
实验步骤
| 预期现象和结论
|
步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中.
| ?
|
步骤2:
| ?
|
步骤3:
| ?
5、选择题 完全沉淀相同体积的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗相同浓度的AgNO3溶液的体积之比为3:2:1,则NaCl、MgCl2、AlCl3溶液的物质的量浓度之比为
A.1:2:3
B.3:2:1
C.6:3:2
D.9:3:1
|