1、选择题 下面是四个化学反应的热化学方程式:
①C(s)+O2(g)=CO2(g) △H1
②2H2(g) +O2(g) =2H2O(l) △H2
③CH3COOH(l) +2O2(g)=2CO2(g)+2H2O(l) △H3
④2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H4
下列焓变之间的关系正确的是
[? ]
A.2△H1=△H2 - △H3+△H4
B.△H2= 2△H1-△H3+△H4
C.△H3=2△H1 +△H2+△H4
D.△H4= 2△H1+△H2-△H3
参考答案:D
本题解析:
本题难度:一般
2、填空题 已知:(1)P4(s,白磷)+ 5O2(g) == P4O10(s) △H1=-2983.2 kJ/mol
(2) ?
?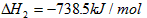
则白磷转化为红磷的热化学方程式_____________________ 。 相同的状况下,能量较低的是________;白磷的稳定性比红磷___________(填“高”或“低”)。
参考答案:P4(s,白磷)==4P(s,红磷) △H=-29.2kJ/mol;红磷;低
本题解析:
本题难度:一般
3、选择题 已知:
Fe2O3(s)+3/2C(s)== 3/2CO2(g)+2Fe(s);△H=234.1KJ/mol
C(s)+ O2(g)== CO2(g);?△H= -393.5KJ/mol
则4Fe(s)+ 3O2(g)== 2Fe2O3(s)的△H是
[? ]
A.-1648.8KJ/mol
B.-824.4KJ/mol
C.+1648.8KJ/mol
D.-744.7KJ/mol
参考答案:A
本题解析:
本题难度:一般
4、简答题 化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.
(1)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)?设计的双液原电池,可以提供稳定的电流.装置如图所示,其中盐桥中装有琼脂-饱和KCl溶液.
回答下列问题:
①电极X的材料和电解质溶液Y分别为______、______;
②盐桥中K+移向______(填A或B);
③银电极发生的电极反应为______.
(2)已知:C(s)+O2(g)=CO2(g)△H1=-396.5kJ?mol-1
H2(g)+1/2O2=H2O(g)△H2=-241.8kJ?mol-1
CO(g)+1/2O2(g)=CO2(g)△H3=-283.0kJ?mol-1
根据盖斯定律写出单质碳和水蒸气生成水煤气的热化学方程式:______.
(3)100mL?1.0mol?L-1盐酸与100mL1.0mol?L-1NaOH溶液在量热计中进行中和反应.测得反应后溶液温度升高了6.8℃,已知稀溶液的比热容为4.2kJ/℃?kg-1,则该中和反应的反应热为______.(小数点后面保留一位有效数字)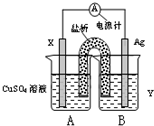
参考答案:(1)①氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)中,活泼的失电子的金属Cu为负极,得电子的阳离子Ag+是电解质中的阳离子,所以电解质可以选择AgNO3溶液;
②原电池反应,B池中Ag+析出,为符合溶液的电中性,盐桥中的钾离子移向B池;
③银电极发生的电极反应为溶液中的银离子得到电子析出银单质,电极反应为:Ag++e-=Ag;
故答案为:Cu、AgNO3溶液;B;Ag++e-=Ag;
(2)①C(s)+O2(g)=CO2(g)△H1=-396.5kJ?mol-1
②H2(g)+1/2O2=H2O(g)△H2=-241.8kJ?mol-1
③CO(g)+1/2O2(g)=CO2(g)△H3=-283.0kJ?mol-1
根据盖斯定律,①-②-③得到:单质碳和水蒸气生成水煤气的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=128.3 kJ?mol-1
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=128.3 kJ?mol-1;
(3)100mL 1.0mol?L-1盐酸与100mL1.0mol?L-1NaOH溶液在量热计中进行中和反应.生成水为0.1mol,测得反应后溶液温度升高了6.8℃,已知稀溶液的比热容为4.2kJ/°C?kg-1,可以根据计算公式计算得到:Q=-C(T2-T1);稀溶液的密度可以近似为1g/ml,所以Q=-C(T2-T1)=-4.2kJ/°C?kg-1×6.8°C×(200ml×1g/ml×10-3kg/g)=5.71KJ;中和反应生成0.1molH2O,中和反应的反应热是生成1mol水时放出的热量,所以反应的中和热为57.1KJ/mol,
故答案为:57.1 kJ?mol-1.
本题解析:
本题难度:一般
5、填空题 烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)烟气脱硫、脱硝的环境意义是________________。
(2)选择性催化还原法的脱硝原理为:6NOx+4xNH3 (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3 mol电子,生成标准状况下N2的体积为___________L。
②已知:
2H2(g)+O2(g)=2H2O(g) △H1=-483.6 kJ/mol
N2(g)+3H2(g)=2NH3(g) △H2=-92.4kJ/mol
N2(g) + O2(g)=2NO(g) △H3= -180.5 kJ/mol
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的 △H=__________。
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图甲,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图乙所示。
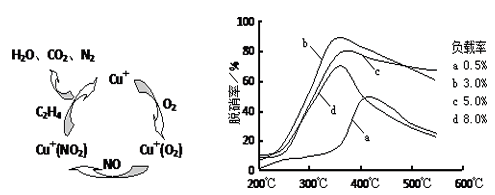
①写出该脱硝原理总反应的化学方程式:_______________________。
②为达到最佳脱硝效果,应采取的条件是______________。
参考答案:(1)防止酸雨的发生
(2)① ;②-724.5 kJ/mol
;②-724.5 kJ/mol
(3)①6NO+3O2+2C2H4 3N2+4CO2+4H2O;②350℃、负载率3%
3N2+4CO2+4H2O;②350℃、负载率3%
本题解析:
本题难度:一般