1、选择题 把镁条直接投入到盛有盐酸的敞口容器里,产生H2速率如图所示。下列因素中,影响反应速率的因素是
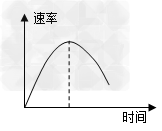
[? ]
①盐酸的浓度
②镁条的表面积
③溶液的温度
④Cl-的浓度
A.①④
B.③④
C.①②③
D.②③
参考答案:C
本题解析:
本题难度:一般
2、简答题 在反应C(s)+CO2(g)?2CO(g)中,可使反应速率明显增大的措施是:①增大压强;②升高温度;③增大CO2的浓度;④增加碳的量;⑤降低压强( )
A.①②③
B.②③④
C.①②③④
D.②③④⑤
参考答案:①增大压强可使反应速率明显增大,故①正确;
②升高温度可加快反应速率,故②正确;
③增大CO2的浓度可加快反应速率,故③正确;
④增加碳的量不影响反应速率,故④错误;
⑤降低压强减小反应速率,故⑤错误.
故选A.
本题解析:
本题难度:一般
3、选择题 将a?g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图中的实线所示,在相同条件下,将b?g?(?a>b?)粉末状碳酸钙与同浓度的盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
A.
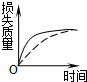
B.
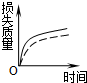
C.

D.

参考答案:因图中实线表示的块状的碳酸钙与足量的盐酸反应,虚线所示粉末状碳酸钙与同浓度的盐酸反应,又粉末状碳酸钙与盐酸的接触面积大,则反应速率快,即相同时间内虚线所示的曲线对应的损失的质量大,因为?a>b导致最终损失的质量a>b,由图象可知,只有C符合,
故选C.
本题解析:
本题难度:简单
4、选择题 在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g) 3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
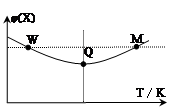
A.升高温度,平衡常数增大
B.W点X的正反应速率等于M点X的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
参考答案:C
本题解析:A、分析图像,X的体积分数先减小后增大,减小到最低,这是化学平衡的建立过程,后增大,这是平衡的移动过程,升高温度,体积分数增大,说明升高温度,平衡向左移动,使平衡常数减小,故A错误; B、M点温度高,故反应速率快,B错误;从开始到Q点是正向建立平衡的过程,转化率逐渐增大,从Q到M点升高温度,平衡向左移动,使转化率降低,Q点最大,故C正确;平衡时再充入Z,达到的新平衡与原平衡是等效平衡,体积分数相等,故D错误;故选C。
本题难度:一般
5、选择题 将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是?
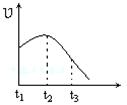
A.从t1→t2的主要原因是镁与酸的反应是放热反应,体系温度升高
B.从t1→t2的主要原因是镁与水反应,致使酸的浓度升高
C.从t2→t3的主要原因是随着反应的进行镁体积减少
D.从t2→t3的主要原因是随着反应的进行温度越来越低
参考答案:A
本题解析:应用镁和盐酸的反应是放热反应,随着温度的升高,反应速率逐渐增大,A正确。但随着反应的进行,氢离子的浓度逐渐减小,所以反应速率又逐渐降低下来,因此BCD都是错误的,答案选A。
本题难度:一般