1、选择题 在由Fe、FeO和Fe2O3组成的混合物中加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(S.P.T),此时溶液中无Fe3+。则下列判断正确的是?(?)

A.混合物中三种物质反应时消耗盐酸的物质的量之比为1:1:3

B.反应后所得溶液中的Fe2+和Cl–的物质的量之比为1:3

C.混合物中,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多

D.混合物中,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
2、简答题 用含少量铁的氧化物的氧化铜制取氯化铜晶体CuCl2xH2O.有如图1操作:

已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解.
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+.检验溶液A中Fe2+的最佳试剂为______(填编号,下同).
①KMnO4?②(NH4)2S?③NaOH?④KSCN
(2)氧化剂可选用______.
①Cl2?②KMnO4?③HNO3?④H2O2
(3)要得到较纯的产品,试剂可选用______.
①NaOH?②FeO?③CuO?④Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是______(按实验先后顺序选填编号).
①过滤?②蒸发浓缩?③蒸发至干?④冷却
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mol,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需______,如图2滴定方式中,最合理的是______(夹持部分略去)(填字母序号).
(6)为了测定制得的氯化铜晶体中CuCl2xH2O中x的值,某兴趣小组设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1g.
方案二:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为n2g.?试评价上述两种实验方案:其中正确的方案是______,据此计算得x=______(用含m、n1或n2的代数式表示).
3、填空题 (NH4)2Fe(SO4)2·6H2O俗名摩尔盐,价格便宜,可用来净水或治疗缺铁性贫血等,是一种重要的化工原料。
(1)摩尔盐的水溶液呈?色。
(2)c(Fe2+)相同的摩尔盐和硫酸亚铁两溶液比较,物质的量浓度较大的是?。
(3)甲乙两位同学想测定一瓶摩尔盐的纯度。甲同学设计的实验装置如图1:
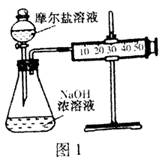
从上图推断甲同学想通过测定?计算摩尔盐的纯度。该方案的不足之处在于?。
(4)乙同学在甲同学的基础上做了改进,其实验装置如图2:
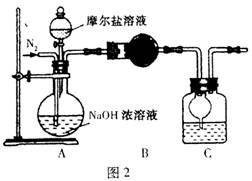
则B与C中的试剂分别是?和?。C中干燥管的作用是?。乙同学称取了10.0g的摩尔盐样品,若实验完毕后测得洗气瓶及瓶内溶液共增重O.68 g,则依此数据推算这份摩尔盐的纯度为?%(答案精确到小数点后第一位)。
4、填空题 现有浓度各为2 mol/L的FeCl3、FeCl2、CuCl2混合溶液100 mL,加入一定量的铁粉,按下列情况填空。
(1)充分反应后,无固体存在,则溶液中一定含有的金属阳离子是?。
(2)反应完毕后,铁粉有剩余,过滤所得的固体物质为?,溶液中一定含有的金属离子的物质的量为?mol。
(3)反应完毕,有固体剩余,则反应后的溶液中一定有的金属阳离子为?,其物质的量取值范围是?。
5、选择题 把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中n(Fe2+): n(Fe3+)=1:2.则已反应的Fe3+和未反应的 Fe3+的物质的量之比为
A.1:2
B.1:3
C.2:3
D.3:2