1、填空题 四氯化钛(TiCl4)是制取航天航空工业材料--钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备
TiCl4等产品的一种工艺流程示意如下
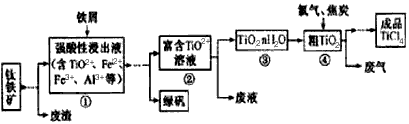
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生。
2Fe3++Fe == 3Fe2+
2TiO2+(无色) +Fe+4H+ === 2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O === TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________。
(2)在②→③工艺中需要控制条件以形成TiO2·nH2O溶胶,该分散质颗粒直径大小在_____________范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+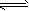 Fe3++H2O的平衡常数K=___________。
Fe3++H2O的平衡常数K=___________。
(4)已知:TiO2(s) +2Cl2(g)=== TiCl4(l) +O2(g) △H=+140KJ·mol-1
2C(s) +O2(g)=== 2CO(g) △H=-221KJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:_____________。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用_____________方法。

参考答案:
(1)生成Ti3+,保护Fe2+不被氧化
(2)10-9~10-7m
(3)2.79×103
(4)TiO2(s)+2C(s)+2Cl2(g)=TiCl4(l)+2CO(g) △H=-81kJ·mol-1
(5)产生了废气,废液,废渣等
(6)蒸馏(或分馏)
本题解析:
本题难度:困难
2、填空题 以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现用硫酸渣制备铁红的过程如下

(1)铁红的主要成分为__________,还原后过滤得到滤渣的主要成分为_________。
(2)酸溶过程中Fe2O3与稀硫酸反应的化学方程式是_______________________
(3)还原过程中加入FeS2是将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式
________________________
(4)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:________________________
(5)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH至3~4,其目的是______________。
参考答案:(1)Fe2O3;SiO2
(2)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
(3)FeS2+14Fe3++8H2O=15Fe2++2SO42-+ 16H+
(4)4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3)
(5)使Fe3+完全沉淀,而其他金属阳离子不生成沉淀
本题解析:
本题难度:一般
3、填空题 三氯化铁在印刷、照像、医药、颜料以及有机合成催化剂方面有重要的应用。三氯化铁易潮解,在100℃时发生升华。通常,工业生产氯化铁有多种方法;其中一种常温氯化法是将氯气直接通入浸泡铁屑的水中来生成FeCl3。
请回答下列问题: ?
(1)完成常温氯化法制氯化铁过程中的化学反应方程式_____________(至少写出两个反应)。 ?
(2)现对制备氯化铁的工艺进行改进,以废铁屑(含有SiO2、Al2O3、MgO、Fe2O3等杂质)为原料。其生产流程如图:?

已知:氢氧化物沉淀过程中的pH:?
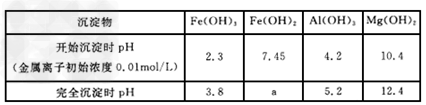
KSPFe(OH)2=1×10-15
①X最好加入_________,写出相应的离子反应方程式_______________
A.KMnO4? B.FeCl3? C.H2O2? D.HNO3
②加入试剂Y的目的是调节pH的范围,试剂Y是____________。上表中a=__________。?
(3)改进后的方法与前一种方法比较优点是_______________。 ?
(4)实验室可以用下图所示装置制取无水三氯化铁。在实验开始时,A、B两个酒精应先点燃一会儿的是____________(填A或B),该装置应如何改进__________。

参考答案:(1)①?Cl2+H2O=HCl+HClO?;②2HCl+Fe=FeCl2+H2↑?; ③2FeCl2+HClO+HCl=2FeCl3+H2O?(2FeCl2+Cl2=2FeCl3?也可)
(2)①C ;?H2O2+2Fe2+ +2H+=2Fe3+ +2H2O ;②Fe2O3?或Fe(OH)3? ;?9
(3)①过程中没有使用有毒的Cl2 ,绿色环保
②反应条件温和
③原料常见低廉
(4)A? ;干燥管末端增加尾气处理装置
本题解析:
本题难度:一般
4、选择题 下列说法中,错误的是( )
A.煤、石油、天然气是当今世界最重要的三种化石燃料
B.我国目前最主要的能源是煤炭
C.人体运动所消耗的能量与化学反应无关
D.人类目前所直接利用的能量大部分是由化学反应产生的
参考答案:C
本题解析:
本题难度:一般
5、填空题 (三选一)【化学与技术】
氮化硅(Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途。 ?
I.工业上有多种方法来制备氮化硅,常见的方法有:?
①方法一?直接氮化法:在1300~1400℃时,高纯粉状硅与纯氮气化合,其反应方程式为__________________________。?
②方法二?化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl,与方法一相比,用此法制得的氮化硅纯度较高,其原因是__________________?
③方法三?Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体__________?(填分子式);然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为_________。 ?
Ⅱ.工业上制取高纯硅和四氯化硅的生产流程如下:
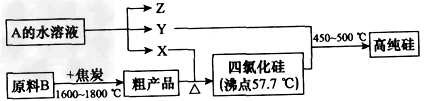
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色。
(1)原料B的主要成分是_____________(写名称)。
(2)写出焦炭与原料B中的主要成分反应的化学方程式:_____________________。
(3)上述生产流程中电解A的水溶液时,____(填“能”或 “不能”)用Cu作为阳极材料;写出Cu为阳极电解A的水溶液开始一段时间阴、阳极的电极方程式:
阳极:__________________;阴极:___________________。
参考答案:I.①3Si+2N2 Si3N4;②方法一所得产品中混有硅而;③方法二除产品是固体外其他物质均为气体,不含固体杂质HCl;NH3
Si3N4;②方法一所得产品中混有硅而;③方法二除产品是固体外其他物质均为气体,不含固体杂质HCl;NH3
Ⅱ.(1)二氧化硅;(2)SiO2+2C Si+2CO↑;(3)不能;Cu-2e-=Cu2+;2H++2e-=H2↑
Si+2CO↑;(3)不能;Cu-2e-=Cu2+;2H++2e-=H2↑
本题解析:
本题难度:一般