1、实验题 钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等].某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下
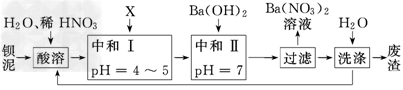
(1)酸溶后溶液的pH=1,Ba(FeO2)2与HNO3反应的化学方程式为____________________________________________________________.
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是________________、____________________________.
(3)该厂结合本厂实际,选用的X为________(填化学式);中和Ⅰ使溶液中________(填离子符号)的浓度减小(中和Ⅰ引起的溶液体积变化可忽略).
(4)上述流程中洗涤的目的是________________________________.
参考答案:(1)Ba(FeO2)2+8HNO3===Ba(NO3)2+2Fe(NO3)3+4H2O
(2)防止反应速率过快;浓HNO3易挥发、分解(凡合理答案均可)
(3)BaCO3;Fe3+、H+
(4)减少废渣中可溶性钡盐对环境的污染(凡合理答案均可)
本题解析:
本题难度:一般
2、填空题 工业上用粗CuO制备CuCl2·2H2O的流程如下

各种离子相关数据如下

请回答:
(1)CuO溶于盐酸的离子方程式是________________。
(2)已知NaClO为强氧化剂,能将Fe2+氧化为Fe3+。
①NaClO溶液显______性(填“酸”或“碱”)。你认为用NaClO作氧化剂是否妥当_______(填“是”或“否”),理由是__________________________。
②另有几种常用的氧化剂,可用作氧化剂X的是__________(填编号)。
a.浓H2SO4 b.Cl2 c.H2O2
(3)试剂Y的作用是调节溶液的pH=3.2得到CuCl2溶液。下列试剂中适宜作试剂Y的是________。
a.NaOH b.Na2CO3 c.CuCO3
参考答案:(1)CuO+2H+=Cu2++H2O (2)①碱;否;引入杂质(或因NaClO溶液显碱性,会将Cu2+转化成沉淀);②bc
(3)c
本题解析:
本题难度:困难
3、填空题 (三选一)【化学——选修化学与技术】
某地有软锰矿和闪锌矿两座矿山,它们的组成如下:
软锰矿:MnO2含量≥65%,SiO2含量约20%,Al2O3含量约4%,其余为水分;
闪锌矿:ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分。
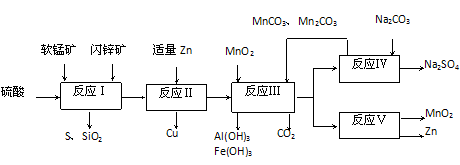
科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
请回答下列问题:
(1)反应I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。试完成反应I中生成CuSO4
和MnSO4的化学方程式:MnO2+CuS+____=_____↓+_______+CuSO4+________
(2)反应Ⅱ加入适量锌的作用是___________;如果锌过量,还会进一步发生反应的离子方程式为______________________。
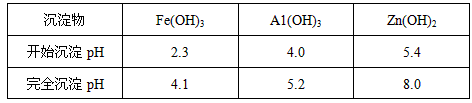
(3)反应III要调节pH生成Fe(OH)3、Al(OH)3,中和过量的H+所使用的物质是___________,调节的pH范围是___________(pH数据见下表)。
(4)本工艺可以循环利用的物质除有MnCO3、ZnCO3以外,还有___________。
参考答案:(1)2H2SO4;S↓;MnSO4;2H2O
(2)将溶液中的硫酸铜转化为铜;Zn + Fe2+=Fe+Zn2+或Zn+Mn2+=Mn+Zn2+
(3)MnCO3、ZnCO3;5.2~5.4
(4)Zn、MnO2
本题解析:
本题难度:一般
4、填空题 工业上生产高氯酸(沸点:90℃)时还同时生产了亚氯酸钠,其工艺流程如下:?
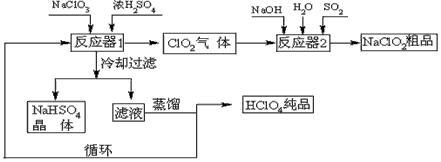
(1)冷却过滤的目的是降低NaHSO4的_________并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为___________。SO2的作用是作___________剂。
(3)循环使用的物质是_____________。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是_____________。
(5)工业上用铂作阳极、铜或银作阴极电解盐酸也可制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)________________。
参考答案:(1)溶解度
(2)2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;还原
(3)H2SO4
(4)高氯酸的沸点比较低,容易从溶液中逸出;
(5)阳极反应式 HCl+ 4H2O -8e-= HClO4 + 8H+ 。
本题解析:
本题难度:一般
5、填空题 工业上制备BaCl2的工艺流程图如下:?
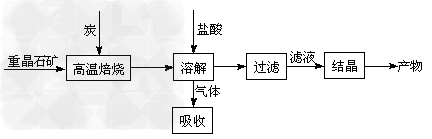
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)?+?4C(s)? 4CO(g)?+?BaS(s)?△H1?=+?571.2?kJ·mol-1?①
4CO(g)?+?BaS(s)?△H1?=+?571.2?kJ·mol-1?①
BaSO4(s)?+?2C(s)? 2CO2(g)?+?BaS(s)?△H2=?+226.2?kJ·mol-1?②
2CO2(g)?+?BaS(s)?△H2=?+226.2?kJ·mol-1?②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为____________。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,?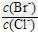 =?_________。?
=?_________。?
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s)?+?CO2(g)? 2CO(g)的△H2=___________?kJ·mol-1。
2CO(g)的△H2=___________?kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是_________,__________。
参考答案:⑴S2-?+?H2O? HS-?+OH-?HS-?+?H2O
HS-?+OH-?HS-?+?H2O ?H2S?+OH-(可不写)?
?H2S?+OH-(可不写)?
⑵2.7×10-3?
⑶+172.5
⑷使BaSO4得到充分的还原(或提高BaS的产量);①②为吸热反应,炭和氧气反应放热维持反应所需高温
本题解析:
本题难度:一般