1、填空题 金属及其化合物在人类生活、生产中发挥着重要的作用。
(1)将一小块金属钠投入盛有水的烧杯中,发生反应的化学方程式为?:
(2)钠、铝、铁三种金属元素所形成的各种氧化物中具有强氧化性的是?(填化学式,下同);适宜做耐火材料的是?;
(3)金属铝既能与盐酸反应,又能与烧碱溶液反应,请写出金属铝与烧碱溶液反应的离子方程式:??。
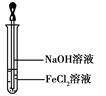
(4)取少量FeCl2溶液,按图所示操作,使其跟NaOH溶液反应。?可观察到试管中出现白色絮状沉淀,继而变成灰绿色,最后变成红褐色,请写出与上述现象相关的反应的化学方程式:?、?。
(5)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是?(填序号)。
A.有铜无铁
B.有铁无铜
C.铁、铜都有
D.铁、铜都无
参考答案:(1)2 Na + 2 H2O =2 NaOH + H2↑;
(2)Na2O2?(1分)? Al2O3。
(3)2Al+2OH-+H2O ==2AlO2-+H2O
(4)FeCl2 + 2NaOH = Fe(OH)2↓+ 2NaCl?4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
(5)B
本题解析:(1)钠与水反应生成氢氧化钠和氢气,化学方程式为2 Na + 2 H2O =2 NaOH + H2↑;
(2)钠、铝、铁三种金属元素所形成的各种氧化物中具有强氧化性的是Na2O2,适宜做耐火材料的是Al2O3,铁的氧化物适宜做颜料;
(3)金属铝与烧碱溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+H2O ==2AlO2-+H2O;
(4)氢氧化钠与氯化亚铁溶液反应先生成白色沉淀,迅速变成灰绿色,最终成为红褐色,发生的化学方程式为FeCl2 + 2NaOH = Fe(OH)2↓+ 2NaCl,4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
(5)铁的还原性强于铜,所以铁先反应,只余铜或铁铜都余或铁铜都反应完都有可能,唯一不可能是有铁无铜,答案选B。
本题难度:一般
2、选择题 向一定量的Fe、FeO、Fe3O4和Fe2O3的混合物中加入240mL?4mol/L的稀硝酸,恰好使混合物完全溶解.放出2.688L?NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现,若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为( )
A.0.42mol
B.0.21mol
C.0.16mol
D.0.14mol
参考答案:因一定量的Fe、FeO、Fe3O4和Fe2O3的混合物中加入240mL?4mol/L的稀硝酸,恰好使混合物完全溶解,
所得溶液中加入KSCN溶液,无血红色出现,则溶液中的溶质为Fe(NO3)2,
2.688LNO(标准状况)的物质的量为2.688L22.4L/mol=0.12mol,
设混合物中铁原子的物质的量为x,由原子守恒可知,则
? 2HNO3~Fe(NO3)2~Fe
? ?2? 1
0.24L×4mol/L-0.12mol?x
21=0.24L×4mol/L-0.12molx,
解得x=0.42mol,
故选A.
本题解析:
本题难度:简单
3、选择题 铜既不溶于稀硫酸,也不溶于KNO3溶液,现有2mol/L稀硫酸15mL,往其中加入2.02g KNO3晶体,充分溶解,该混和液最多可溶解铜的物质的量为
A.0.0075mol
B.0.0225mol
C.0.03mol
D.0.0175mol
参考答案:B
本题解析:2mol/L稀硫酸15mL的物质的量为0.03mol,氢离子的物质的量为0.06mol,2.02g KNO3晶体的物质的量为0.02mol;当向混合溶液中加入铜,发生反应的离子方程式为: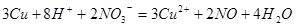 ;由方程式可知硝酸根离子物质的量过量,即氢离子完全反应,消耗铜的物质的量为0.0225mol,
;由方程式可知硝酸根离子物质的量过量,即氢离子完全反应,消耗铜的物质的量为0.0225mol,
本题难度:简单
4、填空题 某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),其实验方案如下:
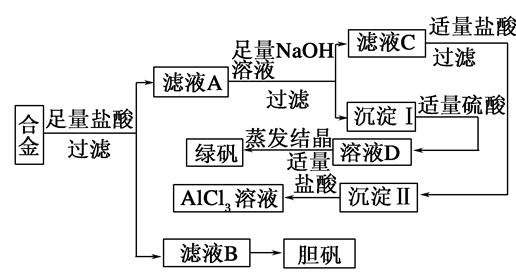
请回答下列问题:
(1)过滤用的玻璃仪器有________。
(2)小组成员经过检测,发现制得的绿矾不纯,试分析原因:________________________,要想由沉淀I最终制得纯度较高的绿矾,应如何改进:______________________。
(3)小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2可以使B溶解,则该反应的化学方程式为______________________。
(4)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能最终制得三种物质,你认为后者方案相对于前者方案________(填“更合理”?或“不合理”),理由是__________。
参考答案:(1)烧杯、漏斗、玻璃棒
(2)反应过程中部分二价铁转化成了三价铁 向溶液D中加入足量铁粉,反应后过滤,取滤液蒸发结晶即可得绿矾
(3)Cu+H2O2+H2SO4=CuSO4+2H2O
(4)更合理 因为前一种方案操作步骤多、时间长、消耗试剂量过大
本题解析:(1)过滤属于基本操作,玻璃仪器有烧杯、漏斗、玻璃棒。
(2)Fe2+很容易被空气中的氧气氧化为Fe3+,加入足量铁粉于溶液中,就可以使Fe3+转化为Fe2+,从而使滤液蒸发结晶即可得绿矾。
(3)稀H2SO4不能直接氧化Cu,加入氧化性的H2O2可氧化。
(4)实验评价在于比较,一般是从试剂成本、反应时间(生产效率)等方面思考,故后者更合理。
本题难度:一般
5、实验题 (12分) 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。?
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
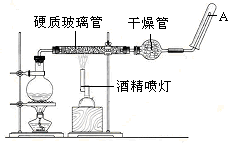
请回答该实验中的问题。
(1)写出该反应的反应方程式:?并指明该氧化还原反应的还原剂是?,氧化剂是?
(2)实验前必须对整套装置进行气密性检查,操作方法是?
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是??烧瓶底部放置了几片碎瓷片,碎瓷片的作是?
(4)酒精灯和酒精喷灯点燃的顺序是??
(5)干燥管中盛装是的物质是?,作用是?
参考答案:(每空1分,化学方程式2分)(1)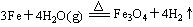 ;Fe;H2O
;Fe;H2O
(2)在玻璃管口A处接一断乳胶管,乳胶管头上连一段玻璃管,并将管口没入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到没入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则标明该套装置气密性良好。
(3)为硬质玻璃管内Fe与水蒸气的反应 实验提供持续不断的水蒸气;防止爆沸事故的发生。
(4)先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯;防止先点燃酒精喷灯所导致的Fe与O2的反应。
(5)碱石灰干燥剂;除去反应产生的H2中的水蒸气。
本题解析:
分析:对于铁与水蒸气反应的化学方程式,本题应该给出生成的铁的氧化物是哪一种,不然学生很难写出此化学方程式,还原剂的判定方法是与氧结合的物质,氧化剂是失去氧的物质.检验装置气密性的方法一般用加微热的方法,根据冒出的气泡和回流的水柱来判断.如果在一套装置中需要两处加热,一定要注意点燃加热仪器的顺序,一般是根据实验的安全性和对实验结果的影响来考虑.干燥管内固体干燥剂一般用无水氯化钙或固体氢氧化钠和碱石灰等,要注意干燥剂不能和被干燥的物质反应.点燃氢气前一定要检验纯度,防止发生爆炸.
解答:解:(1)铁与水蒸气发生氧化还原反应,考虑生成物应该是氢气和铁的氧化物,还原剂的判定方法是与氧结合的物质,这里就是铁,氧化剂是失去氧的物质,这里是水.故答案为:3Fe+4H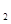 O
O Fe
Fe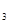 O
O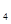 +4H
+4H ?铁 水
?铁 水
(2)检查装置的气密性一般根据热胀冷缩的原理用加微热的方法:答案为:在玻璃管口A处接一段乳胶管,乳胶管头上连一段玻璃管,并将管口没入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到没入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则标明该套装置气密性良好.
(3)因为反应物为水蒸气与铁,所以这里加热的目的就是提供水蒸气,放碎瓷片的目的是防止沸腾事故发生.答案为:为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气
(4)点燃加热仪器的顺序要考虑实验的安全性和对实验结果的影响,在本实验中为了防止铁与空气中的氧气在加强热的条件下反应,应该先点燃酒精灯.故答案为:先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯;防止铁与空气中的氧气在加强热的条件下反应,应该先点燃酒精灯.
(5)干燥氢气可以用碱石灰干燥剂.故答案:碱石灰 除去反应产生的H2中的水蒸气
故答案为:氢气;
点评:本题难度较大,涉及到很多高中化学知识,同学们要掌握常见的检验气密性,检验气体纯度的方法.
本题难度:一般