1、选择题 下列排列顺序正确的是?(?)
①热稳定性:H2O>HF>H2S?②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4?④离子半径:O2->F—>Na+
A.①③
B.②④
C.①④
D.②③
参考答案:B
本题解析:①非金属性越强,氢化物的热稳定性越高,H2O,HF,H2S三种物质中,HF的稳定性最强。所以①错误。
②从电子层和质子数上分析,正确。
③最高价氧化物酸性与元素非金属性呈正比关系,所以硫酸,高氯酸酸性都比磷酸要强。
④正确,电子层相同,核电荷数越多,离子半径越小。
所以正确选项为B
本题难度:一般
2、选择题 关于元素周期表,下列叙述中不正确的是(?)
A.周期表中的族分为:主族、副族、0族和VIII族
B.周期表中的周期分为:短周期、长周期和不完全周期
C.过渡元素全部是副族元素
D.由短周期元素和长周期元素共同组成的族称为主族(除0族外)
参考答案:C
本题解析:考查元素周期表的结构。
副族元素和VIII族元素共同构成过渡元素,所以答案是C。
本题难度:一般
3、选择题 下列性质的递变中,正确的是
A.O、Na、S的原子半径依次增大
B.LiOH、KOH、CsOH的碱性依次增强
C.HF、NH3、SiH4的稳定性依次增强
D.HCl、HBr、HI的还原性依次减弱
参考答案:B
本题解析:A.对于电子层数相同的微粒来说,原子序数越大,原子半径越小。因此Na>S;对于电子层数不同的元素来说,原子核外电子层数越多,原子半径就越大,所以S>O。因此原子半径大小关系是:Na>S>O。错误。B.元素的金属性:Li<K<Cs.元素的金属性越强,其对应的最高价氧化物的水化物的碱性就越强,因此减小LiOH < KOH <CsOH。正确。C.元素的非金属性F>N>Si。元素的非金属性越强,其对应的简单的氢化物的稳定性就越强,因此稳定性:HF>NH3>SiH4。错误。D.元素的非金属性越强,其对应的简单氢化物的还原性就越弱。由于非金属性:Cl>Br>I。所以还原性:HI> HBr> HCl。错误。
本题难度:简单
4、填空题 (3分)按已知的原子结构规律,82号元素X应是第___________周期___________族元素,它的最高正价氧化物的化学式为______________。
参考答案:6? ⅣA? XO2或PbO2
本题解析:考查周期表的结构。因为82-2-8-8-18-18=28,所以该元素属于第六周期。在第六周期中最右侧的元素是0族的Rn,原子序数是86,则86-82=4,即该元素所在的族和0族之间还有3列,所以该元素属于第ⅣA。主族元素的最高正价是族序数,所以该元素的最高价是+4价,因此最高价氧化物的化学式为XO2或PbO2。
本题难度:一般
5、选择题 X、Y、Z、W四种短周期主族元素的原子序数依次增大,X在短周期主族元素中原子半径最大,Y是地壳中含量最高的金属元素,Z的最高正化合价与最低负化合价的代数和为4。下列说法正确的是
A.X的单质和水反应的离子方程式为 X+H2O===X-+OH-+H2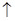
B.Y的氧化物是碱性氧化物
C.最高价氧化物对应水化物的碱性:X<Y
D.气态氢化物的稳定性:Z<W
参考答案:D
本题解析:根据原子半径的周期性变化知X为Na。Y为Al,根据化合价知Z为S,再由短周期主族元素的原子序数依次增大确定W为Cl。A项电荷不守恒,错误;Al2O3为两性氧化物,B错误;Na的金属性比Al强,则碱性NaOH强些C错误;S的非金属性比Cl弱,则气态氢化物的稳定性HCl稳定,D正确。
本题难度:一般