1、填空题 (10分)肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。试回答下列问题
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为_________。
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:

N2(g)+2O2(g)=2NO2(g)?△H =-67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)?△H =-534. 0kJ·mol-1
2NO2(g) N2O4(g)?△H =-52.7kJ·mol-1
N2O4(g)?△H =-52.7kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方________。
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,写出反应的离子方程式为_?__。
(4)如图所示,A是由易导热材料制成的体积不变的密闭容器,B是一耐化学腐蚀且易于传热的体积可变的透明气囊(体积改变过程中囊体弹力改变忽略不计)。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。

①B中可通过________________判断可逆反应2NO2 N2O4已经达到平衡。
N2O4已经达到平衡。
②若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则?平均化学反应速率v(NO2)等于____________________(用含a、t的代数式表示)。
④若平衡后在A容器中再充入0.5mol NO2,则重新到达平衡后,平衡混合气中NO2的体积分数_______________(填 “变大”“变小”或“不变”)。
参考答案:(10分)(1)N2H4-4e-+4OH-=N2+4H2O
(2)2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)?△H=-947.6 kJ· mol-1
(3) 2NH3+CIO-=N2H4+Cl-+H2O
(4)①气囊B的体积不再减小或气体颜色不再变化(其他合理答案给分)
②0.7L。③? mol·L-1·s-1④变小
mol·L-1·s-1④变小
本题解析:(1)原电池中负极失去电子,正极得到电子。因此肼再负极通入,氧气在正极通入。又因为电解质是氢氧化钾,所以左侧即负极反应式是N2H4-4e-+4OH-=N2+4H2O。
(2)根据盖斯定律可知,②×2-①-③即得到反应式2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),所以该反应的分液△H=-534. 0kJ·mol-1×2+67.7kJ·mol-1+52.7kJ·mol-1=-947.6 kJ· mol-1。
(3)根据反应物和生成物可知,该反应的离子方程式是2NH3+CIO-=N2H4+Cl-+H2O。
(4)①由于在反应过程中气体的体积是变化的,所以可以通过气囊B的体积变化来判断,又因为NO2是红棕色的气体,所以也可以通过气体颜色的变化来判断。即气囊B的体积不再减小或气体颜色不再变化时,即说明反应到达平衡状态。
②打开K2,则相当于是在等温等压时的平衡,因此平衡时等效的。由于此时反应物的物质的量是B中的二倍,所以打开K2之前,气球B体积为(aL+0.4aL)÷2=0.7aL。
③设消耗NO2的物质的量是x,则根据方程式2NO2=N2O4可知,生成N2O4的物质的量是x/2,则1-x+x/2=0.8,解得x=0.4mol,所以NO2的反应速率是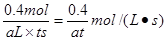 。
。
④由于反应物和生成物都是一种,所以再冲入NO2,则相当于是增大压强,平衡向正反应方向移动,因此NO2的含量降低。
本题难度:一般
2、选择题 锌、铜和稀硫酸组成的原电池,下列有关说法正确的是(?)
①锌极有气泡产生?②电子由Zn经外电路流向Cu
③负极:Zn +2e-=Zn2+?④Cu2+在溶液中由Cu棒向Zn棒迁移
A.①②④
B.②③
C.②
D.②④
参考答案:C
本题解析:①锌极是负极,发生溶解,铜极是正极,产生气泡,故错;③负极失去电子,发生氧化反应,故错;④阳离子移向正极,即铜极,故错。故选C。
点评:本题考查学生原电池的工作原理,可以根据所学知识进行回答,题目难度不大。
本题难度:简单
3、选择题 氢氧燃料电池以 H2 为还原剂, O2为氧化剂,电极为多孔镍,电解液为 30% 的 KOH 溶液,下列有关叙述正确的是 ( )
①负极反应为 4OH-→O 2+ 2H 2 O+ 4 e-?
②负极反应为 H 2+ 2OH-→ 2H 2 O+ 2 e-?
③工作时正极区 pH 升高,负极区 pH 降低 ?
④工作时溶液中阴离子移向正极?
A.③④
B.②③
C.②④
D.①④
参考答案:B
本题解析:略
本题难度:简单
4、选择题 目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如图)。关于此循环体系,下列说法中错误的是(?)
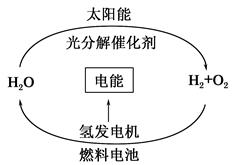
A.燃料电池能够使化学反应产生的能量转化为电能
B.燃料电池中通入H2的一极作负极,发生氧化反应
C.在此循环中发生了反应:2H2O?2H2↑+O2↑
D.目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂
参考答案:C
本题解析:氢氧燃料电池的负极通入H2,发生氧化反应;正极通入O2,发生还原反应,故B正确。原电池都是将化学能转化为电能的装置,故A正确。推广氢能的关键是寻找合适的催化剂,利用太阳能分解水。
本题难度:一般
5、选择题 下列叙述正确的是
[? ]
A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1molNaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
参考答案:C
本题解析:
本题难度:一般