1、选择题 下列说法不正确的是
A.对于Na2SO4,从组成上看,既属于钠盐,又属于硫酸盐
B.对于Na2SO4和Na2S,从组成上看,都可以看作钠盐,又可以看作硫酸盐
C.每一种元素都可以在一定条件下以单质或化合物的形态存在
D.血糖属于混合物
参考答案:B
本题解析:Na2S不属于硫酸盐,而是硫化物.
本题难度:困难
2、选择题 下列哪一个参数近似会造成元素的性质最相似(? )
A.第一电离能
B.电负性
C.原子半径
D.电子层构型
参考答案:C
本题解析:从原理上说,不同的几种元素的上述几种参数近似,都可能造成元素性质在某些方面有相似之处,但当元素的原子半径近似时元素性质更接近一些,例如40号元素锆和72号元素铪,它们原子半径近似,元素性质非常接近,以至于使用很多方法都不能将它们分离开来。
本题难度:一般
3、选择题 (8分)现有几种元素的性质或原子结构如下表:
元素编号
| 元素性质或原子 结构 结构
|
T
| 失去一个电子后,形成Ne原子电子层结构
|
X
| 最外层电子数是次外层电子数的2倍
|
Y
| 其单质之一是空气中主要成分,最常见的助燃剂
|
Z
| 形成双原子单质分子,黄绿色气体
|
?
(1)元素X的一种同位素用来作原子量标准,这种同位素的符号是?▲?。
(2)画出T的原子结构示意图?▲?。
(3)写出工业上制取单质Z的化学方程式?▲?。
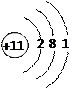 (4)写出由T、Y和Z三种元素组成的一种化合物在水溶液中的电离方程式?▲?。
(4)写出由T、Y和Z三种元素组成的一种化合物在水溶液中的电离方程式?▲?。
参考答案:
通电
本题解析:略
本题难度:一般
4、填空题 (26分)下表是周期表中的一部分题目要求回答
族
周期
| I A
| Ⅱ A
| Ⅲ A
| Ⅳ A
| Ⅴ A
| Ⅵ A
| Ⅶ A
|
1
| A
| ?
| ?
| ?
| ?
| ?
| ?
|
2
| ?
| ?
| ?
| E
| F
| ?
| ?
|
3
| B
| C
| D
| ?
| G
| H
| I
|
(1)写出A元素的名称??,H元素的符号??
在这9种元素中,原子半径最大的是?,画出G元素的原子结构示意图?
A和F组成化合物的结构式?元素F的单质电子式为??
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是?,呈两性的氢氧化物是?。(填化学式)
(3)写出B的单质与水反应的化学方程式?
(4)元素E的单质与Fe和稀硫酸构成原电池,试在右面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出负极的电极反应为____________________。

 (5)在一定条件下,元素F与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下元素G与H2反应的限度(选填“更大”、“更小”或“相同”) ? ?
(5)在一定条件下,元素F与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下元素G与H2反应的限度(选填“更大”、“更小”或“相同”) ? ?
参考答案:(26分)(化学方程式和作图各3分,其余每空2分)
(1)A的名称?氢?H 的符号? S?原子半径最大的是? Na ?,
G的原子结构示意图、结构式、电子式(略)
(2)酸性最强的是? HClO4,呈两性的氢氧化物是Al(OH)3?。(填化学式)
(3)化学方程式? 2Na+2H2O==2NaOH+H2
(4)负极的电极反应为___Fe-2e—==Fe2+_? (图略)
 (5)限度(选填“更大”、“更小”或“相同”) ? 更小
(5)限度(选填“更大”、“更小”或“相同”) ? 更小
本题解析:本题考查了原子结构、元素周期律的相关知识,难度较小,
(1)A的名称?氢?H 的符号? S?原子半径最大的是? Na ?,
G的原子结构示意图、结构式、电子式

(2)酸性最强的是? HClO4,呈两性的氢氧化物是Al(OH)3?。(填化学式)
(3)化学方程式? 2Na+2H2O==2NaOH+H2
(4)负极的电极反应为___Fe-2e—==Fe2+_

 (5)限度(选填“更大”、“更小”或“相同”) ? 更小
(5)限度(选填“更大”、“更小”或“相同”) ? 更小
本题难度:一般
5、选择题 下列叙述正确的是( )?
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.R2+离子核外有a个电子,b个中子,R原子表示为: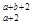 R
R
C.碱金属元素是指ⅠA族的所有的元素
D.除短周期外,其它周期均为18种元素
参考答案:B
本题解析:A项:除零族元素外,短周期元素的最高化合价在数值上不一定都等于该元素所属的族序,如氟元素没有正价,氧元素没有最高正价,故错;C项:H元素位于ⅠA族,但不是碱金属元素,故错;D项:第七周期是不完全周期,故错。故选B。
点评:本题考查学生元素周期律的应用知识,可以根据所学知识进行回答,难度不大。
本题难度:简单