1、填空题 硝酸铝广泛用于有机合成、印染工业等。工业上以铝灰为原料(主要成分为Al,含少量Al2O3、Fe2O3、SiO2、CaO、MgO等)制备硝酸铝的工艺流程如下:
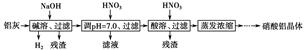
已知:Al(OH)3沉淀和溶解的pH如下表:
Al(OH)3
| 开始沉淀
| 沉淀完全
| 沉淀开始溶解
| 沉淀溶解完全
|
pH
| 3.3
| 5.0
| 7.8
| 12.8
|
?
回答下列问题:
(1)碱溶时,发生主反应的离子方程式为________________________________。
(2)工艺流程中第一次加入硝酸调pH=7.0的目的是__________________________________________________________。
pH=7.0时,溶液中c(Al3+)=________(通常条件下,Ksp[Al(OH)3]=1.3×10-33)。
(3)若忽略杂质跟酸、碱的反应,则在碱溶、调pH=7.0、酸溶过程中,理论上消耗碱、酸的物质的量之比n1(NaOH)∶n2(HNO3)∶n3(HNO3)=________。
(4)现用1 t铝灰制硝酸铝晶体[Al(NO3)3·9H2O],最后生产出7.5 t硝酸铝晶体,若生产过程中铝元素的损失率为10%,计算铝灰中铝元素的质量分数。
参考答案:(1)2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)使Al(OH)3沉淀完全 1.3×10-12 mol·L-1
(3)1∶1∶3
(4)60%
本题解析:(1)注意铝灰的主要成分为Al,主要反应是铝与碱的反应。(2)结合流程图可知,调节pH=7.0时,过滤得到的沉淀再加HNO3,得硝酸铝,可知沉淀为Al(OH)3。c(Al3+)=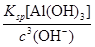 =1.3×10-12 mol·L-1。(3)碱溶、调pH=7.0、酸溶的反应分别为:2Al+2OH-+2H2O=2AlO2-+3H2↑、AlO2-+H++H2O=Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O,得n1(NaOH)∶n2(HNO3)∶n3(HNO3)=1∶1∶3。
=1.3×10-12 mol·L-1。(3)碱溶、调pH=7.0、酸溶的反应分别为:2Al+2OH-+2H2O=2AlO2-+3H2↑、AlO2-+H++H2O=Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O,得n1(NaOH)∶n2(HNO3)∶n3(HNO3)=1∶1∶3。
(4)设铝元素的质量分数为x
Al ~ Al(NO3)3·9H2O
27 375
1 t×(1-10%)×x 7.5 t
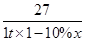 =
=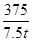
解得:x=0.6(或60%)
本题难度:一般
2、选择题 准确称取6.0g铝土矿样品(含SiO2、Fe2O3),加入100mL稀硫酸中,充分反应后向滤液中加入10mol?L-1NaOH溶液,产生沉淀的质量/g(纵坐标)和加入NaOH溶液体积/mL(横坐标)之间的关系如下图所示。则所用硫酸物质的量浓度为(mol?L-1)
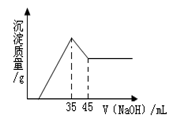
A.1.75
B.3.50
C.0.85
D.无法确定
参考答案:A
本题解析:略
本题难度:简单
3、填空题 工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如图
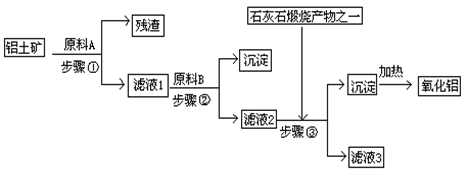
⑴原料A的名称是_____________,步骤①反应的离子方程式是_________________。
⑵滤液1中要加入稍过量原料B,原料B的化学式是________________,步骤②反应的离子方程式是:__________________________________________。
⑶步骤③的化学方程式是:_____________________________________________。
⑷如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响____________________________________________________________。
参考答案:⑴盐酸(硫酸、硝酸)? Al2O3+6H+=2Al3++3H2O? Fe2O3+6H+=2Fe3++3H2O
⑵NaOH? H++OH-=H2O? Fe3++3OH-=Fe(OH)3 ↓? Al3++4OH-=AlO2-+2H2O
⑶NaOH+CO2=NaHCO3、NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
⑷若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质
本题解析:(1)石灰石煅烧的生成物是CO2,这说明步骤③中加入的是CO2,所以滤液②中含有偏铝酸钠。因此原料B是氢氧化钠,则滤液①中氯化铝,所以试剂①是盐酸(或稀硫酸、硝酸等)。二氧化硅与酸是不反应的,所以步骤①中的离子方程式是
Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O。
(2)滤液①中含有过量的盐酸,以及生成的氯化铝和氯化铁,所以加入过量的氢氧化钠时反应的离子方程式是H++OH-=H2O、Fe3++3OH-=Fe(OH)3 ↓、Al3++4OH-=AlO2-+2H2O。
(3)滤液③中含有过量的氢氧化钠以及生成的偏铝酸钠,所以通入过量的CO2时的化学方程式是NaOH+CO2=NaHCO3、NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3。
(4)若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后在生成的氢氧化铝中混有硅酸沉淀,硅酸分解生成二氧化硅,使加热制得的Al2O3混有SiO2杂质,所以不能省去步骤①。
本题难度:一般
4、选择题 称取两份铝粉,第一份加入足量的浓氢氧化钠溶液,第二份加入足量的稀盐酸,如要放出等体积的气体(在同温同压下),两份铝的质量之比为……( ?)
A.1:2
B.1:3
C.3:2
D.1:1
参考答案:D
本题解析:铝能与酸及强碱溶液发生氧化还原反应放出氢气。反应中铝均作还原剂,而产生的氢气都是由H+(盐酸或水中)得电子被还原而成的,根据在氧化还原反应中得、失电子总数相等的原则,可快速求解。
铝与盐酸反应时,由Al→Al3+;铝与浓NaOH反应时,Al→AlO2-,每摩铝均失去3摩电子。而产生氢气都是由H+(盐酸或水中)得电子被还原:2H++2e=H2↑,根据氧化还原反应中得失电子总数相等的原则,既然放出氢气的体积相等,那么在两个反应中消耗的铝的物质的量一定相等,故质量也相等,即应选D。
本题难度:一般
5、选择题 将两种金属混合而成的粉末30 g,与足量的盐酸反应,产生氢气22.4 L,该混合物可能是(?)
A.镁和铜
B.钠和锌
C.铁和钙
D.铝和镁
参考答案:A
本题解析:由极限法分析:若全部为选项中某金属产生氢气22.4 L所消耗的质量分别为:镁24 g、钠46 g、锌65 g、铁56 g、钙40 g、铝18 g,铜不反应可认为需要无穷大的质量,混合物30 g就可产生同样量的气体,一定含有镁,答案为A。
本题难度:简单