1、填空题 镁铝尖晶石(MgAl2O4)常做耐火材料。共沉淀制备尖晶石的方法是:用AlCl3和MgCl2的混合溶液(用a表示)与过量的氨水(用b表示)反应,再将得到的沉淀高温焙烧。完成下列填空:
(1)为使Mg2+、Al3+同时生成沉淀,应该把?(填“a”或“b”)滴入另一溶液中。
(2)将上述制备反应中部分元素的简单离子:Al3+、Cl–、Mg2+、H+、O2–按半径由大到小的顺序排列
?(用离子符号表示)。
(3)AlCl3与氨水反应的反应物和生成物中,属于离子化合物的电子式是?,属于难溶物的电离方程式?。
(4)不能说明氧元素的非金属性比氮元素强的事实是_________。
a.? H2O比NH3稳定?b. 共用电子对偏向:H-O>H-N
c. 沸点:H2O>NH3 ?d.? NO中氮是+2价,氧是-2价
参考答案:(1)a(1分) ?
(2)Cl->O2->Mg2+>Al3+>H+
(3)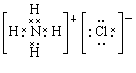 (1分) H++AlO2–+H2O
(1分) H++AlO2–+H2O Al(OH)3
Al(OH)3 Al3++3OH–(2分)
Al3++3OH–(2分)
(4)c(2分)
本题解析:(1)为使Mg2+、Al3+同时生成沉淀,应该把AlCl3和MgCl2的混合溶液滴入到过量的氨水中,因此正确的答案选a。
(2)根据微粒电子层越多,半径越大.。在核外电子排布相同的条件下,核电荷数越多,微粒半径越小,据此可知离子的半径大小顺序是Cl->O2->Mg2+>Al3+>H+。
(3)AlCl3与氨水反应生成氢氧化铝沉淀和氯化铵,氯化铵是离子化合物,电子式为 。氢氧化铝是两性氢氧化物,其电离方程式为H++AlO2-+H2O
。氢氧化铝是两性氢氧化物,其电离方程式为H++AlO2-+H2O Al(OH)3
Al(OH)3 Al3++3OH-。
Al3++3OH-。
(4)a.非金属性越强,氢化物的稳定性越强,所以根据H2O比NH3稳定,可以证明氧元素的非金属性比氮元素强,故a错误;b.共用电子对偏向:H-O>H-N,证明氧原子的得电子能力强于氮原子,即氧元素的非金属性比氮元素强,故b错误;c.沸点:H2O>NH3是物理性质的表现,但是氧元素的非金属性比氮元素强是化学性质的表现,故C正确;d.NO中氮是+2价,氧是-2价,证明氧原子的得电子能力强于氮原子,即氧元素的非金属性比氮元素强,故d错误,答案选c。
本题难度:一般
2、选择题 将15.6g?Na2O2和5.4g?Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是( )
A.反应过程中得到6.72L(标准状况)的气体
B.最终无沉淀生成
C.最终得到的溶液中c(NaCl)=1.5mo/L
D.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
参考答案:15.6gNa2O2的物质的量为15.6g78g/mol=0.2mol,5.4gAl的物质的量为5.4g27g/mol=0.2mol,6.72LHCl气体的物质的量为6.72L22.4L/mol=0.3mol.
所发生的有关反应为2Na2O2+2H2O═4NaOH+O2↑;2Al+2H2O+2NaOH═2NaAlO2+3H2↑;HCl+NaOH═NaCl+H2O,NaAlO2+HCl+H2O═Al(OH)3↓+NaCl.
2Na2O2+2H2O═4NaOH+O2↑
0.2mol?0.4mol?2.24L?
2Al+2H2O+2NaOH═2NaAlO2+3H2↑
0.2mol?0.2mol?0.2mol? 6.72L
A、反应中共得到气体的体积为2.24L+6.72L=11.2l,故A错误;
B、将15.6gNa2O2和5.4gAl同时放入一定量的水中,反应后溶液的成分为0.2molNaOH和0.2molNaAlO2,加入0.3molHCl,反应后溶液的成分是0.3molNaCl和0.1molNaAlO2,生成0.1mol氢氧化铝沉淀,故B错误;
C、反应后溶液的成分是0.3molNaCl和0.1molNaAlO2,所以c(NaCl)=0.3mol0.2L=1.5mo/L,故C正确;
D、反应后溶液的成分是0.3molNaCl和0.1molNaAlO2,由电荷守恒可知c(Na+)=c(Cl-)+c(OH-)+c(AlO2-)-c(H+)
,故D错误.
故选:C.
本题解析:
本题难度:一般
3、选择题 铝在人体中积累可使人慢慢中毒,1989年世界卫生组织正式将铝确定为食品污染源之一并加以控制。铝在下列场合使用必须加以控制的是?(?)
①制铝锭,②制易拉罐,③制电线电缆,④制牙膏皮,⑤用明矾净水,⑥制炊具,⑦用明矾和小苏打做食品膨化剂,⑧用请氢氧化铝[Al(OH)3]制成药片制胃病,⑨制防锈油漆
A.①②④⑤⑥⑦⑧
B.②⑤⑥⑦⑨
C.②④⑤⑥⑦⑧
D.③④⑤⑥⑦⑧
参考答案:C
本题解析:本题要注意题干要求世界卫生组织正式将铝确定为食品污染源之一并加以控制,所有要找到和食品有接触关系的铝制品,所以可以得出符合的项目有②④⑤⑥⑦⑧,正确答案为C。
本题难度:一般
4、计算题 (4分)NaOH、MgCl2、AlCl3的混合物溶于H2O后,加入0.5mol/L的稀盐酸溶液,变化如图,求:
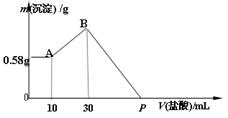
(1)混合物中NaOH的质量是??g。
(2)P点所表示盐酸加入体积为?mL。
参考答案:(2分/空,共4分) (1) 2.6 g?(2)130 mL
本题解析:略
本题难度:简单
5、填空题 氯化铝融盐电解法是以氯化铝为原料,以碱金属或碱土金属氯化物(含少量MgCl2、KCl、CaCl2)为电解质进行电解制取铝的方法。
(1)氯化铝融盐电解法需要先制纯氧化铝。以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料通过以下途径提纯氧化铝:

①依次写出X、Y的成分?,??。
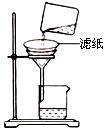
②如图所示在实验室中进行过滤,操作中的两处错误分别是?;?。
(2)制备无水氯化铝的反应为:2Al2O3+6Cl2 4AlCl3+3O2
4AlCl3+3O2
③为促进该反应的进行,实际生产中需加入焦炭,其原理是?。
④加入焦炭后的化学反应可表示为Al2O3+C+Cl2 AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断)?,请说明理由?。
AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断)?,请说明理由?。
(3)现在工业上通常用电解熔融氧化铝方式制取铝,理论上生产1吨铝消耗的氧化铝的质量_________
(填“大于”、“小于”、“等于”)氯化铝质量。
参考答案:(10分)(1)①NaOH溶液(1分);?稀盐酸(1分)
②没有使用玻璃棒引流;滤纸边缘高于漏斗边缘(2分)
(2)③碳与O2反应,有利于反应正向进行(2分)
④不正确。将生成气体先通过灼热的CuO粉末,若有CO就会生成CO2,这样就无法确定原来是否有CO2。(2分)?(3)小于(2分)
本题解析:(1)①滤液乙能和氨水反应生成氢氧化铝沉淀,这说明滤液乙中含有铝离子,所以Y应该是盐酸。则滤液甲中含有AlO2-和SiO32-,因此X是NaOH。氧化铁和氢氧化钠不反应,过量得到氧化铁。硅酸钠和盐酸反应生成硅酸沉淀,过量得到氯化铝和盐酸的混合液,加入氨气即生成氢氧化铝沉淀。
②根据装置图可知,该装置是过滤装置,因此主要的错误在于没有使用玻璃棒引流,其次滤纸边缘高于漏斗边缘。
(2)③因为在加热的条件下,碳与O2反应,生成CO或CO2,降低氧气的浓度,有利于反应正向进行。
④由于在加热的条件下,CO能和氧化铜反应生成CO2,所以将生成气体先通过灼热的CuO粉末,若有CO就会生成CO2,这样就无法确定原来是否有CO2,所以是不正确的。
(3)根据原子守恒可知,1mol氧化铝可以生成2mol氯化铝。1mol氧化铝的质量是102g,2mol氯化铝的质量是2mol×133.5g/mol=267g,所以氧化铝的质量小于氯化铝的质量。
本题难度:一般