1、选择题 CO与H2的混合气体V mL,完全燃烧后消耗O2 ?mL(相同状况),则原混合气体中CO和H2的体积比为(?)
?mL(相同状况),则原混合气体中CO和H2的体积比为(?)
A.1∶1
B.2∶1
C.10∶7
D.任意比
参考答案:D
本题解析:由方程式2CO+O2 2CO2、2H2+O2
2CO2、2H2+O2 2H2O知,每摩尔CO和H2燃烧需O2量相同,故V mL CO和H2的混合气体,无论二者以何种比例混合,完全燃烧消耗O2一定为
2H2O知,每摩尔CO和H2燃烧需O2量相同,故V mL CO和H2的混合气体,无论二者以何种比例混合,完全燃烧消耗O2一定为 ?mL。
?mL。
本题难度:简单
2、简答题 如图是某学校实验室从化学试剂商店买回的浓盐酸试剂标签上的部分内容.现用该浓盐酸配制100mL?1mol?L-1的稀盐酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒.请回答下列问题:
(1)配制稀盐酸时,还缺少的仪器有______(写出仪器名称及规格);
(2)经计算,配制100mL1mol?L-1的稀盐酸需要用量筒量取上述浓盐酸的体积为______mL,量取盐酸时应选用______mL(选填10mL、50mL、100mL)规格的量筒;
(3)对所配制的稀盐酸进行测定,发现其浓度小于1mol?L-1,引起误差的原因可能是______.
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
(4)若将30mL?1mol?L-1盐酸与4.2gNaHCO3充分反应,在标准状况下可得多少升CO2(写出化学方程式和计算过程).
参考答案:(1)100mL?1mol?L-1的稀盐酸需要的仪器有:量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,故还缺少100mL容量瓶,
故答案为:100mL容量瓶;
据此解答;
(2)该浓盐酸的物质的量浓度为1000×1.18×36.5%36.5mol/L=11.8mol/L,根据稀释定律,稀释前后溶质硫酸的物质的量不变,令需要钠元素的体积为V,则:
100mL×1mol/L=V×11.8mol/L
解得:V=8.5mL
故选择10mL的量筒,
故答案为:8.5,10;
(3)A.定容时俯视容量瓶刻度线,液面在刻度线以下,溶液的体积偏小,所配溶液的浓度偏大,故A不符合;
B.配制需加水定容,容量瓶在使用前未干燥,里面有少量蒸馏水,对所配溶液浓度无影响,故B不符合;
C.转移溶液后,未洗涤烧杯和玻璃棒,少量HCl沾在烧杯内壁和玻璃棒上,移入容量瓶中HCl的物质的量偏小,所配溶液浓度偏小,故C符合;
D.定容摇匀后发现液面低于容量瓶的刻度线,少量溶液残留在瓶塞与瓶口之间,再加水至刻度线,溶液体积偏大,所配溶液浓度偏小,故D符合;
故选CD;
(4)n(HCl)=0.030L×1mol?L-1=0.03mol,n(NaHCO3?)=4.2g84g/mol=0.05mol,令0.05mol碳酸氢钠完全反应需要HCl的物质的量为xmol,则:
HCl+NaHCO3=NaCl+H2O+CO2↑
1? ? 1
xmol?0.05mol
故x=0.05mol,由于0.05mol>0.03mol,故HCl不足,NaHCO3过量,根据HCl计算生成二氧化碳,由方程式可知0.03molHCl反应生成二氧化碳的物质的量为0.03mol,故生成的二氧化碳的体积为0.03mol×22.4L/mol=0.672L,
答:生成的二氧化碳的体积为0.672L.
本题解析:
本题难度:一般
3、计算题 (8分)在标准状况下,1体积水溶解了448体积氯化氢气体,所得溶液密度为1.18 g·cm-3,求盐酸的质量分数和物质的量浓度。
参考答案:42.4%,13.6 mol·L-1
本题解析:w(HCl)=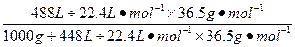 ×100%=42.2%,
×100%=42.2%,
c(HCl)=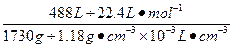 ="13.6" mol·L-1。
="13.6" mol·L-1。
本题难度:简单
4、选择题 下列溶液中,与100 mL 0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是(?)
A.100 ml 0.5 mol/L MgCl2溶液
B.200 ml 0.25 mol/L HCl溶液
C.50 ml 1 mol/L NaCl溶液
D.200 ml 0.25 mol/L CaCl2溶液
参考答案:D
本题解析:略
本题难度:简单
5、选择题 用NA表示阿伏加德罗常数的数值,下列说法中正确的是(?)
A.常温常压下,氧气和臭氧的混合物16g中含有NA个氧原子
B.常温下,5.6g铁与足量的盐酸反应,失去的电子数为0.3NA
C.盛有CO2的密闭容器中含 有NA个氧原子,则CO2的物质的量不一定是0.5mol
有NA个氧原子,则CO2的物质的量不一定是0.5mol
D.1mol·L-1NaCl溶液含有NA个Na+离子
参考答案:A
本题解析:略
本题难度:一般