1、选择题 Na与水反应的化学方程式2Na + 2H2O == 2NaOH + H2↑,在反应中水
A.是氧化剂
B.是还原剂
C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂
参考答案:A
本题解析:试题分析:根据方程式可知,水中氢元素的化合价从+1价降低到0价,得到电子,所以水是氧化剂,钠是还原剂,答案选A。
考点:考查氧化还原反应的有关判断
点评:进行氧化还原反应的有关判断的关键是准确标出有关元素的化合价变化情况,然后再依据相关的概念进行分析和判断即可。
本题难度:简单
2、填空题 过度排放CO2会造成温室效应,最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把
CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下
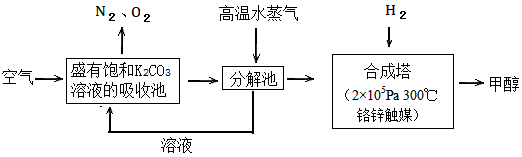
(1)写出吸收池中主要反应的离子方程式_________________;在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式
________________。
(2)“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括________。
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式________________。当电子转移的物质的量为________时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)工业上常以CO和H2为主要原料,生产甲醇。某密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
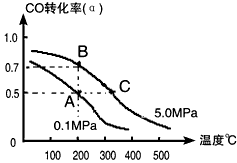
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数
K=__________;此时在B点时容器的体积VB________10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA________tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是______________(答出两点即可)。
参考答案:(1)CO32-+ CO2+H2O==2HCO3-;CO2(g)+3H2(g) ==CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol
(2)高温水蒸气
(3)CH3OH+8OH--6e-==CO32-+6H2O;1.2mol
(4)①1(L/mol)2;小于;②大于;③降温、加压、将甲醇从混合体系中分离出来(任意两点即可)
本题解析:
本题难度:一般
3、选择题 在水中加入等物质的量的Ag+、Pb2+、Na+、SO42-、NO3-、Cl-,该溶液放在用惰性材料作电极的电解槽中,通电片刻(假定溶液足量),则氧化产物与还原产物的质量比为
[? ]
A.35.5:108
B.71:108
C.8:1
D.16:207
参考答案:C
本题解析:
本题难度:一般
4、选择题 在某化学反应中,铜离子得到2.408×1023个电子,则可得到铜单质( )
A.25.6g
B.32g
C.12.8g
D.38.4g
参考答案:C
本题解析:
本题难度:简单
5、选择题 己知25mL?0.1mol/L?Na2S2O3溶液恰好把224mL?Cl2(标准状况)完全反应为Cl-,则S2O32-将转化为
A.S2-
B.S
C.SO32-
D.SO42-
参考答案:D
本题解析:分析:由25mL?0.1mol/L?Na2S2O3溶液恰好把224mL?Cl2(标准状况)完全反应为Cl-,则氯气作氧化剂,Na2S2O3作还原剂,利用电子守恒来计算.
解答:氯气的物质的量为 =0.01mol,
=0.01mol,
Na2S2O3的物质的量为0.025L×0.11mol/L=0.0025mol,
反应中氯气作氧化剂,Na2S2O3作还原剂,
设S2O32-被氧化后S元素的好化合价为x,则
由电子守恒可知,
0.01mol×2×(1-0)=0.0025mol×2×(x-2),
解得x=+6,
故选D.
点评:本题考查氧化还原反应中电子守恒的计算,明确Cl元素的化合价降低,则S元素的化合价升高时解答本题的关键,然后利用电子守恒即可解答.
本题难度:简单