1、填空题 (1)新制备的氯水显______色,说明氯水中有______(填分子式)分子存在.
(2)向氯水中滴加几滴AgNO3溶液,立即有______生成,说明氯水中有______(填化学式)存在,反应的化学方程式为______.
(3)氯水光照后颜色变浅,并放出______色的气体.
参考答案:(1)氯气为黄绿色气体,微溶于水,新制备的氯水显黄绿色,是由于氯水中有Cl2,故答案为:黄绿;Cl2;
(2)氯气通入硝酸银溶液中,发生Cl2+H2O=HCl+HClO,HCl+AgNO3=AgCl↓+HNO3,溶液中有白色沉淀生成,
故答案为:白色沉淀;HCl;HCl+AgNO3=AgCl↓+HNO3;
(3)HClO不稳定,见光易分解,反应为:2HClO?光照?.?2HCl+O2↑,光照条件下溶液颜色逐渐变浅,并有无色气泡产生,故答案为:无.
本题解析:
本题难度:一般
2、选择题 含有a mol FeBr2的溶液中,通入xmol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
[? ]
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列物质中,不能通过氯气与单质直接化合制取的是( )
A.NaCl
B.CuCl2
C.FeCl2
D.HCl
参考答案:A.NaCl可由Na和Cl2化合反应生成,故A不选;
B.CuCl2可由Cu和Cl2化合反应生成,故B不选;
C.Fe和Cl2化合反应生成FeCl3,不能得到FeCl2,故C错误;
D.HCl可由H2和Cl2化合反应生成,故D不选.
故选C.
本题解析:
本题难度:一般
4、填空题 亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如下:

(1)A的化学式是??,装置III中A在?极区产生。
(2)II中反应的离子方程式是?。
(3)通电电解前,检验III中阴离子的方法和步骤是?。
(4)为防止II中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,还可以选择的还原剂是 ??(填字母编号)。
a.Na2O2?b.FeCl2?c.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07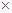 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中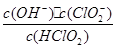 = ?。
= ?。
(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时所得溶液中离子浓度由大到小的顺序是 ?
参考答案:(1)H2SO4?(2分)?阳(2分)
(2)2ClO2+H2O2+2OH-=2ClO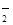 +O2↑+2H2O (3分)
+O2↑+2H2O (3分)
(3)取少量Ⅲ中溶液少许于试管中,先加入足量稀盐酸,无沉淀生成,再加入BaCl2溶
液,产生白色沉淀,证明含有SO42-?(3分)
(4)a(2分)
(5)1.07×1010mol·L-1 (3分)
(6)c(H+)>c(SO42-)>c(Cu2+)>c(OH-) (3分)
本题解析:(1)Ⅲ为电解硫酸钠溶液,本质是电解水,阴极2H++2e-=H2↑,阳极4OH--4e-=O2↑+2H2O,另一电极产生NaOH,因为该电解池为离子隔膜电解池,所以A为硫酸,在阳极区产生。
(2))Ⅱ中反应根据流程信息可知,生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应中ClO2是氧化剂,发生还原反应,HCl是还原剂,发生氧化反应,根据电子转移守恒可知4n(ClO2)=n(HCl),所以反应方程式为:2NaOH+2ClO2+H2O2=2?NaClO2+2H2O+O2↑,离子方程式是2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O。
(3)III中阴离子为SO42?,检验方法为:取少量Ⅲ中溶液少许于试管中,先加入足量稀盐酸,无沉淀生成,再加入BaCl2溶液,产生白色沉淀,证明含有SO42- ?
(4)加入FeCl2和Na2S会产生杂质,而Na2O2不会产生新的杂质,故a项正确。
(5)II中反应所得NaClO2溶液(含少量NaOH)的pH=13,可得c(H+)=1×10-13mol?L?1,则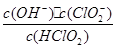 =
=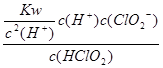 =1.07×1010mol·L-1 。
=1.07×1010mol·L-1 。
(6)电解硫酸铜溶液的化学方程式为:2CuSO4+2H2O 2H2SO4+2Cu+O2↑,生成铜3.2 g,则反应了CuSO4的物质的量为0.05mol,生成H2SO4的物质的量为0.05mol,则所得溶液含0.05mol的CuSO4和0.05mol的H2SO4,Cu2+水解生成H+,所以离子浓度由大到小的顺序为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。
2H2SO4+2Cu+O2↑,生成铜3.2 g,则反应了CuSO4的物质的量为0.05mol,生成H2SO4的物质的量为0.05mol,则所得溶液含0.05mol的CuSO4和0.05mol的H2SO4,Cu2+水解生成H+,所以离子浓度由大到小的顺序为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。
本题难度:困难
5、选择题 下列反应中,光照对反应几乎没有影响的是
[? ]
A.氯气与氢气的反应
B.氯气与甲烷的反应
C.氧气与甲烷的反应
D.次氯酸的分解
参考答案:C
本题解析:
本题难度:简单