1、填空题 (7分)氯水中存在的分子有:?和H2O,离子有:?和极微量的OH-,向其中滴加几滴石蕊,溶液先变红,后褪色的原因是:???
参考答案:Cl2、HClO?(2分)? H+ ? Cl- ClO-(3分)?氯水中的H+
? Cl- ClO-(3分)?氯水中的H+ 使石蕊显红色,后HClO的强氧化性又使红色褪去。(2分)
使石蕊显红色,后HClO的强氧化性又使红色褪去。(2分)
本题解析:略
本题难度:一般
2、简答题 氯气是一种化学性质很活泼的单质,它具有较强的氧化性,下列叙述中不正确的是( )
A.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟
B.氯气通入品红溶液中,溶液会褪色,是因为氯气具有漂白性
C.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰
D.氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸
参考答案:A、因红热的铜丝在氯气里剧烈燃烧生成固体氯化铜,则会观察到棕黄色的烟,故A正确;
B、氯气通入品红溶液中,溶液会褪色,是氯气与水反应生成的HClO具有漂白性使其褪色,故B错误;
C、纯净的H2在Cl2中安静地燃烧生成HCl,观察到苍白色火焰,故C正确;
D、氯气能与水反应生成HClO和HCl,久置会发生2HClO?光照?.?2HCl+O2↑,则最终为稀盐酸,故D正确;
故选B.
本题解析:
本题难度:一般
3、选择题 在图示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大。则气体X与液体Y不可能是(?)

?
| A
| B
| C
| D
|
气体X
| NH3
| SO2
| CO2
| HCl
|
液体Y
| 水
| 浓NaOH
| 稀H2SO4
| 称食盐水
参考答案:C
本题解析:液体滴入瓶中,气球胀大,说明瓶中气体压强减少。氨气极易溶于水、二氧化硫与浓氢氧化钠溶液反应、氯化氢溶于水都使瓶中气体压强减小,二氧化碳气体在水中溶解度不大。
点评:氨气和氯化氢气体极易溶于水,二氧化硫、二氧化碳、氢气、硫化氢等气体可与浓氢氧化钠溶液反应而使气体压强减小,以上均可形成喷泉实验。
本题难度:一般
4、实验题 实验室用MnO2和浓盐酸制取氯气并验证氯气的部分性质,实验装置如下图所示。
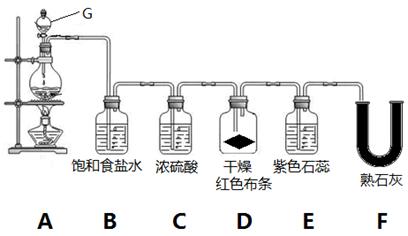
(1)G装置名称___________________。A装置的离子反应化学方程式是?,氧化剂与还原剂的物质的量之比为?。
(2)B装置的作用是_____________。
(3)实验开始几分钟后,D装置红布条是否褪色__________,E装置中观察到的现象是_____________
_____________________________________________________________。
(4)装置F中发生反应的化学方程式是_____________________________________________________。(5)F装置后应再连接一个尾气处理装置,装置里加入NaOH溶液,尾气处理的离子反应方程式为_____
____________________________________________________。
参考答案:(1)分液漏斗(1分)?MnO2+4H++2Cl- Mn2++Cl2↑+2H2O(2分)?1:2?(1分) Mn2++Cl2↑+2H2O(2分)?1:2?(1分)
(2)除氯气中的氯化氢(1分)?(3) 不褪色,?(1分)?先变红后褪色?(1分)
(4)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O?(2分) (5)Cl2+2OH-=Cl-+ClO-+H2O?(2分)
本题解析:(1)根据装置的特点可知,G装置是分液漏斗;A装置是制备氯气的,反应的离子反应方程式是MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。其中二氧化锰中Mn元素的化合价从+4价降低到+2价,得到2个电子,二氧化锰是氧化剂。氯化氢中氯元素的化合价从-1价升高到0价,失去1个电子,氯化氢是还原剂。根据电子得失守恒可知,氧化剂与还原剂的物质的量之比是1:2。 Mn2++Cl2↑+2H2O。其中二氧化锰中Mn元素的化合价从+4价降低到+2价,得到2个电子,二氧化锰是氧化剂。氯化氢中氯元素的化合价从-1价升高到0价,失去1个电子,氯化氢是还原剂。根据电子得失守恒可知,氧化剂与还原剂的物质的量之比是1:2。
(2)由于浓盐酸易挥发,生成的氯气中含有氯化氢,所以B装置的作用是除氯气中的氯化氢。
(3)由于生成的氯气先经过浓硫酸被干燥,干燥的氯气不能使有色布条褪色,所以实验开始几分钟后,D装置红布条不褪色。氯气溶于水生成盐酸和次氯酸,溶液具有酸性和强氧化性,所以E装置中观察到的现象是先变红后褪色。
(4)氯气是酸性气体,与熟石灰反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
(5)氯气有毒需要尾气处理,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
本题难度:一般
5、选择题 硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见图).下列说法正确的是( )
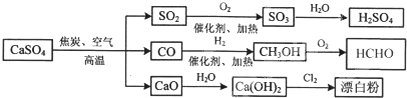
A.CO、SO2、SO3均是酸性氧化物
B.除去与水反应,图示转化反应均为氧化还原反应
C.工业上利用Cl2和澄清石灰水反应来制取漂白粉
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
参考答案:A.CO不能与碱反应,不是酸性氧化物,故A错误;
B.除去与水反应,图示转化反应都是与氧气反应或氢气反应,都一定有化合价升降,均为氧化还原反应,故B正确;
C.澄清石灰水中氢氧化钙的浓度较小,应用纯净的消石灰,故C错误;
D.工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?

?CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?

?CH3OH(g)+H2O(g)△H2
反应Ⅱ中不是所有原子进入期望产物,原子利用率不为100%,故D错误.
故选B.
本题解析:
本题难度:简单
|