1、简答题 化学--选修物质结构与性质
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为______.(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点______(填高或低),理由是______.
(3)E的最高价氧化物分子的空间构型是______.
(4)F的核外电子排布式是______,F的高价离子与A的简单氢化物形成的配离子的化学式为______.
(5)A、F形成某种化合物的晶胞结构如图所示,则其化学式为______;(黑色球表示F原子)
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型为______.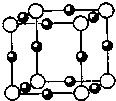
参考答案:原子核外有三个未成对电子,其电子排布式为1S22S22P3,为N元素,E原子核外的M层中只有两对成对电子,电子排布式为1S22S22P63S23P4,应为S元素,C元素是地壳中含量最高的金属元素,为Al元素,化合物B2E的晶体为离子晶体,B应为第ⅠA族元素,且原子序数在N元素和Al之间,应为Na元素,D单质的熔点在同周期元素形成的单质中是最高的,应为Si元素,单质硅为原子晶体,熔点在第三周期中最高,F原子核外最外层电子数与B相同,其余各层均充满,且原子序数最大,电子排布式为1S22S22P63S23P63d104S1,应为Cu元素.
(1)在元素周期表中,同一周期元素的第一电离能从左到右逐渐增大,同一主族元素的第一电离能从上到下逐渐减小,据此可判断四种元素的第一电离能的顺序为:Na<Al<Si<N,故答案:Na<Al<Si<N;
(2)因NaCl为离子晶体而SiCl4为分子晶体,原子晶体的熔沸点远大于分子晶体的熔沸点,故答案为:高;NaCl为离子晶体而SiCl4为分子晶体;
(3)S03中含有3个δ键,孤电子对数为6-2×32=0,所以分子的空间构型是平面正三角形,故答案为:平面正三角形;
(4)根据能量最低原理书写电子排布式为:1s22s22p63s23p63d104s1(或[Ar]3d104s1),铜离子与氨气可以配位键形成配合物,其化学式为,[Cu(NH3)4]2+;
故答案为:1s22s22p63s23p63d104s1(或[Ar]3d104s1);[Cu(NH3)4]2+;
(5)根据晶胞中微粒个数的分配方法计算,晶胞中含有N原子的数目为8×18=1,Cu原子的数目为:12×14=3,故化学式为Cu3 N,故答案为:Cu3 N;
(6)根据化合物具有高沸点和高硬度,是一种新型无机非金属材料,可判断晶体类型为原子晶体,化学键类型为共价键,故答案为:共价键.
本题解析:
本题难度:一般
2、推断题 A、B、C、D、E、F六种物质在一定条件下的相互转化关系如图所示(所有反应物和生成物均已给出)。
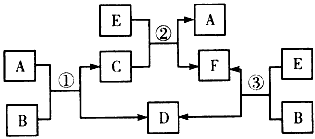
(1)若反应①、②、③均为水溶液中的置换反应,且A、D、E为卤素单质,则A、D、E的氧化性由强到弱的顺序为_________,其中A的化学式是___________。
(2)若B是一种能使湿润的红色石蕊试纸变蓝的气体,C是一种溶于强碱而不溶于B的水溶液的白色沉淀,图中B与E反应生成D。则气体B的空间构型为_________,反应①的离子方程式为_________________。
(3)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应②的化学方程式为
___________________
(4)若B是一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环,则化合物B的电子式为_____________,用电子式表示物质A的形成过程__________________,F的饱和溶液与足量E反应的离子方程式为______________________。
参考答案:(1)E>A>D;Br2
(2)三角锥形;3NH3·H2O+Al3+= 3NH4++Al(OH)3↓
(3)Fe3O4+4CO 4CO2 +3Fe
4CO2 +3Fe
(4)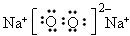 ;
;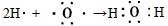 ;CO2+2Na+ + CO32- + H2O=2NaHCO3↓
;CO2+2Na+ + CO32- + H2O=2NaHCO3↓
本题解析:
本题难度:一般
3、推断题 下列物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为深棕红色极易挥发液体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
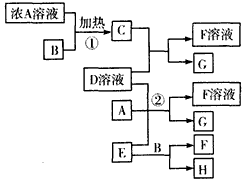
请回答下列问题:
(1)反应①的化学方程式为____________________。
(2)反应②的离子方程式为____________________。如果有16gG生成,反应过程中转移电子的物质的量是_______mol。
(3)写出另外一种实验室制取H的化学方程式:______________________。
(4)工业制硫酸的关键反应是用H与大气污染物之一的气体物质反应,其反应的化学方程式是___________________,该反应的平衡常数表达式是___________。
(5)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=6.60×10-6。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mol/L,则生成沉淀所需Pb(NO3)2溶液的最小浓度为_____________。
参考答案:(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)6Br-+ClO3-+6H+=3Br2+Cl-+3H2O;0.2
(3)2H2O2 2H2O+O2↑或2KMnO4
2H2O+O2↑或2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(4)2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
(5)0.528mol/L
本题解析:
本题难度:一般
4、简答题 下图中A是一种无色液体,G是一种极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应5是工业制X的主要反应之一.
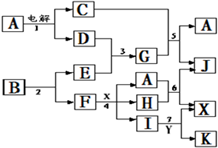
请按要求填空:
(1)写出下列物质的化学式
A?、E?、F?、K?;
(2)写出反应5的化学方程式?
(3)1molB通过反应2得到1molF,B中F的质量分数为72%,则B的化学式为?.
(4)写出反应4的离子方程式?.
参考答案:A是一种无色液体,A为H2O,G是一种极易溶于水的碱性气体,则G为NH3,由转化关系图可知,C为O2,D为H2,则E为N2,Y是胃酸的主要成分,Y为HCl,K是不溶于稀硝酸的白色沉淀,K为AgCl,反应5是工业制X的主要反应之一,则X为硝酸,反应5为氨气的催化氧化反应,再结合转化关系图可知,F为Ag,所以B中含有Ag、N两种元素,反应4为Ag与硝酸的反应,(1)由上述推断可知A为H2O,E为N2,F为Ag,K为AgCl,故答案为:H2O;N2;Ag;AgCl;
(2)反应5为氨气的催化氧化反应,氨气与氧气反应生成一氧化氮和水,反应的方程式为4NH3+5O2催化剂.△4NO+6H2O,
故答案为:4NH3+5O2催化剂.△4NO+6H2O;
(3)1molB通过反应2得到1molF,设B的化学式为AgNx,则108108+14x×100%=72%,解得x=3,所以B的化学式为AgN3,故答案为:AgN3;?
(4)反应4为Ag与硝酸的反应,结合反应6可知,Ag与硝酸反应生成NO2,离子反应为Ag+2H++NO3-═Ag++NO2↑+H2O,故答案为:Ag+2H++NO3-═Ag++NO2↑+H2O.
本题解析:
本题难度:一般
5、填空题 (12分)下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
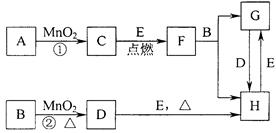
(1)写出有关物质的名称或化学式:F?,H?。
若反应①是在加热条件下进行,则A是?;若反应①是在常温条件下进行,则A是?。
(2)写出B与MnO2共热获得D的离子方程式? ?。
?。
(3 )B的稀溶液与AgNO3溶液混合可形成沉淀AgX,此沉淀的Ksp(AgX) =1.8×10-10。将等体积的B稀溶液与AgNO3溶液混合,若B的浓度为2×10—4
)B的稀溶液与AgNO3溶液混合可形成沉淀AgX,此沉淀的Ksp(AgX) =1.8×10-10。将等体积的B稀溶液与AgNO3溶液混合,若B的浓度为2×10—4 mo1/L
mo1/L  ,则生成沉淀所需AgNO3溶液的最小浓度为________。若向AgX悬浊液中滴加KI溶液,观察到的现象?,沉淀能够发生转化的原因是?。
,则生成沉淀所需AgNO3溶液的最小浓度为________。若向AgX悬浊液中滴加KI溶液,观察到的现象?,沉淀能够发生转化的原因是?。
参考答案:

本题解析:略
本题难度:一般