1、选择题 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是(? )
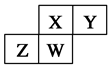
A.原子半径:W>Z>Y>X
B.气态氢化物的稳定性:Z>W>X>Y
C.W的最高正化合价与负化合价的绝对值可能相等
D.Z的最高价氧化物的水化物可能为强碱
参考答案:C
本题解析:A、Z、W同周期,所以原子半径Z>W,错误;B、Y的非金属性最强,所以气态氢化物最稳定,错误;C、从图中判断W是第四到第六主族的短周期元素,若为第四主族,则最高正化合价与负化合价的绝对值相等,正确;D、Z若为金属只能是Al,最高价氧化物的水化物是两性氢氧化物,错误,答案选C。
本题难度:一般
2、填空题 短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素是地壳中含量最多的金属元素。
填写下列空白:
(1)写出D的氧化物的一种用途?
(2)常温下,A的最高价氧化物对应水化物的浓溶液可用C单质制成的容器盛放,原因是??;但NaOH溶液能溶解C的单质,有关的离子方程式为?。
(3)A、B两种元素的气态氢化物结合质子的能力由大到小的顺序为?(填化学式),用一个离子方程式证明?
(4)常温下,A的某种氧化物为红棕色气体,1 mol该气体与水完全反应放出46kJ热量,写出该反应的热化学方程式?
(5)A的气态氢化物为甲,甲遇浓盐酸产生白烟,用电子式表示白烟的化学组成?。常温下,向VL pH=a的甲的水溶液中加入VL pH=b的盐酸,且a+b=14,则反应后溶液的pH?7(填“>”、“<”或“无法确定”),所得溶液中各种离子的浓度由大到小的顺序是??。
参考答案:(14分)(1)制备单晶硅、玻璃、光导纤维、建筑材料等(合理答案即可给分)(1分)
(2)在常温下,铝被浓硫酸氧化生成致密的氧化膜,阻碍反应进一步发生。(2分)
2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
(3)NH3﹥H2O(1分); NH3+H3O+=NH4++H2O(2分)
(4)3 NO2(g)+ H2O(l)=2HNO3(aq)+ NO(g); △H=-138 kJ/mol(2分)
(5) (1分)?> (1分)? c(NH4+) >c(Cl-)>c(OH-) >c(H+)(2分)
(1分)?> (1分)? c(NH4+) >c(Cl-)>c(OH-) >c(H+)(2分)
本题解析:C元素是地壳中含量最多的金属元素,则C是Al。因此根据元素在周期表中的相对位置可知,D是Si,A是N,B是O。
(1)二氧化硅的用途有制备单晶硅、玻璃、光导纤维、建筑材料等。
(2)常温下,铝在浓硝酸中发生钝化,铝被浓硫酸氧化生成致密的氧化膜,阻碍反应进一步发生,因此浓硝酸可以用铝单质制成的容器盛放。但氢氧化钠溶液可以溶解铝单质,反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。
(3)氨气是碱性气体,溶于水显碱性,能和酸反应生成铵盐,所以氨气结合质子的能力强于水的,应该的离子方程式是NH3+H3O+=NH4++H2O。
(4)常温下,A的某种氧化物为红棕色气体,则A是NO2,所以反应的热化学方程式是3 NO2(g)+ H2O(l)=2HNO3(aq)+ NO(g); △H=-138 kJ/mol。
(5)氨气和浓盐酸反应生成氯化铵而冒白烟,氯化铵是含有离子键和共价键的离子化合物,电子式是 。由于氨水是弱碱,所以如果a+b=14,这说明在反应中氨水一定是过量的,则溶液显碱性,即pH大于7。则根据电荷守恒可知,溶液中离子浓度的大小顺序是c(NH4+) >c(Cl-)>c(OH-) >c(H+)。
。由于氨水是弱碱,所以如果a+b=14,这说明在反应中氨水一定是过量的,则溶液显碱性,即pH大于7。则根据电荷守恒可知,溶液中离子浓度的大小顺序是c(NH4+) >c(Cl-)>c(OH-) >c(H+)。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
3、填空题 已知元素A和B的原子序数都小于18,A元素原子的最外层电子数为a,次外层电子数为b,B元素M层电子数为 a-b,L层电子数为 a+b。请完成下列问题:
(1) 元素A在周期表中的位置?
(2) 元素A的原子结构示意图?
(3) 元素B的单质的一种用途?
(4) 用B的氧化物的一种用途?
(5) B元素的氧化物与NaOH溶液反应的化学方程式
?
参考答案:(10分,每小题2分)(1)第二周期第ⅥA族? (2)
(3)电脑芯片,太阳能电池板 (4)光导纤维 (5)2NaOH + SiO2=Na2SiO3 + H2O
本题解析:L层排满时可以容纳8个电子,则a+b=8。A元素原子的最外层电子数为a,次外层电子数为b,由于次外层电子数并能超过8个,则b一定等于2,所以a=6,则A是氧元素,B是硅元素。
(1) 元素A在周期表中的位置第二周期第ⅥA族;
(2) 元素A的原子结构示意图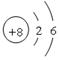 ;
;
(3) 元素B的单质的一种用途电脑芯片,太阳能电池板等;
(4) 用B的氧化物的一种用途制备光导纤维;
(5) B元素的氧化物与NaOH溶液反应的化学方程式2NaOH + SiO2=Na2SiO3 + H2O。
点评:该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
4、选择题 短周期元素X 、Y、Z在周期表中的位置如图所示,则下列说法正确的是?(?)
、Y、Z在周期表中的位置如图所示,则下列说法正确的是?(?)
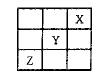
A.Z一定是活泼的金属
B.Y元素与第IA族的元素只能形成离子化合物
C.X、Y、Z三种元素中X元素的得电子能力最强
D.Z的最高价氧化物的水化物是强酸
参考答案:D
本题解析:略
本题难度:简单
5、填空题 X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息见下表:
元素
| 相关信息
|
X
| X的基态原子核外的三个能级上电子数相等
|
Y
| Y与X同周期,Y基态原子p能级的成对电子数与未成对电子数相等
|
Z
| Z的单质是一种银白色活泼金属,在空气中燃烧后生成淡黄色的固体
|
W
| 向含W2+的溶液中滴加强碱,其白色氢氧化物在空气中迅速变成灰绿色,最后变成红褐色
|
?
(1)W位于周期表的第______周期_____族,其基态原子最外层有________个电子。
(2)X的最简单氯化物分子呈____________型结构, Z在空气中燃烧生成的淡黄色的固体中含有的化学键类型____________________。
(3)若将金属Z投入含WCl3的溶液中,发生反应的离子方程式为____________________。
(4)工业上冶炼W过程涉及以下两个热化学方程式:
3W2Y3(s)+XY(g) =2W3Y4(s)+XY2(g)?△H=-15.73kJ/mol
W3Y4(s)+XY (g) =" 3WY" (s)+XY 2(g)?△H= +640.4kJ/mol
则反应W2Y3 (s)+XY (g) =" 2" WY (s)+XY 2(g) 的△H= _________________?。
参考答案:(1)四、 Ⅷ、? 2
(2)正四面体、 离子键?(非极性)共价键
(3)6Na+6H2O+2Fe3+=6Na++3H2↑+2Fe(OH)3↓
(4)ΔH= +421.69kJ/mol.
本题解析:根据题目提供的信息可知:X为C;Y为O;Z为Na;W是Fe。(1)26号元素Fe在元素周期表中位于第四周期第Ⅷ族。基态原子最外层有2个电子。(2)C的最简单氯化物分子CCl4呈正四面体结构。Na在空气中燃烧产生Na2O2. 在离子化合物Na2O2中含有Na、O之间的离子键及O、O之间的非极性共价键。(3)Na投入到FeCl3溶液中时,首先发生反应:2Na+2H2O=2NaOH+H2↑,然后发生:FeCl3+3NaOH=Fe(OH)3↓+3NaCl.总方程式为6Na+6H2O+2FeCl3=6NaCl+3H2↑+2Fe(OH)3↓.离子方程式为:6Na+6H2O+2Fe3+=6Na++3H2↑+2Fe(OH)3↓ 。(①+②×2)÷3整理可得Fe2O3 (s)+CO(g) =" 2" FeO (s)+CO2(g)? ΔH= +421.69kJ/mol.
本题难度:一般