1、简答题 MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料.实验室模拟以MnO2为原料生产MnCO3的工艺流程如图1: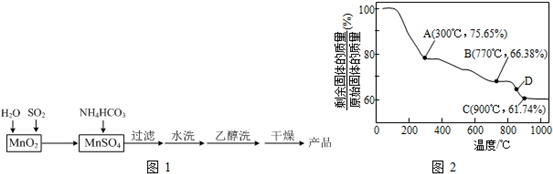
已知:MnCO3难溶于水和乙醇,受热易分解.
(1)实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、______.
(2)①检验水洗是否合格的方法是______.②水洗结束后,用乙醇洗涤的目的是______.
(3)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图2所示.则300℃时,剩余固体中n(Mn):n(O)为______;图中点D对应固体的成分为______(填化学式).
参考答案:(1)过滤操作需要漏斗,玻璃棒,烧杯;
故答案为:玻璃棒;
(2)①分析流程可知,碳酸氢铵和硫酸锰反应生成碳酸锰沉淀,洗涤目的是洗去沉淀表面的硫酸根离子和铵根离子,设计方案为:取最后一次洗涤滤出液少许于一支试管中,向其中滴加盐酸酸化的氯化钡溶液,若无明显现象,说明水洗合格;
故答案为:取最后一次洗涤滤出液少许于一支试管中,向其中滴加盐酸酸化的氯化钡溶液,若无明显现象,说明水洗合格;
②水洗后,用乙醇洗涤,依据乙醇的性质分析,乙醇是易挥发的液体,操作中便于沉淀低温干燥,防止碳酸锰受热分解
故答案为:乙醇易挥发,便于低温干燥,防止MnCO3受热分解;
(3)设MnCO3的物质的量为1mol,即质量为115g
①A点剩余固体质量为115g×75.65%=87g
减少的质量为115g-87g=28g
可知MnCO3失去的组成为CO
故剩余固体的成分为MnO2
剩余固体中n(Mn):n(O)=1:2;
故答案为:1:2;
②C点剩余固体质量为115g×61.74%=71g
据锰元素守恒知m(Mn)=55g,则m(O)1=71g-55g=16g
则n(Mn):n(O)=5555:1616=1:1
故剩余固体的成分为MnO
同理,B点剩余固体质量为115g×66.38%=76.337g
因m(Mn)=55g,则m(O)2=76.337g-55g=21.337g
则n(Mn):n(O)=5555:21.33716=3:4
故剩余固体的成分为Mn3O4
因D点介于B、C之间,故D点对应固体的成分为Mn3O4与MnO的混合物;
故答案为:Mn3O4与MnO;
本题解析:
本题难度:一般
2、实验题 在常温下,Fe与水并不起反应,但在高温下,红热的铁能与水蒸气反应,有氢气生成,现用下图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题
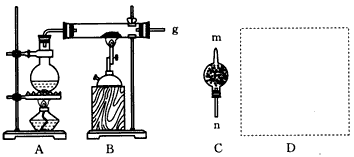
(1)写出铁在高温下与水蒸气反应的化学方程式:________________________。
(2)干燥管C内盛放的药品是____或____。干燥管的____(填“m”或“n”)端与g导管相连接。
(3)在D处画出用简单方法(用试管)来收集氢气的装置图(所需其他仪器自己选择)。
(4)圆底烧瓶中盛装的是水,该装置受热后的主要作用是_________________。
(5)怎样用简单的方法检验收集到的气体是氢气,简述实验操作步骤和现象________________。
参考答案:(1)3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
(2)CaCl2;碱石灰(或CaO,答案合理均可);n? (3) (4)为硬质玻璃管内Fe与水蒸气的反应提供持续不断的水蒸气
(4)为硬质玻璃管内Fe与水蒸气的反应提供持续不断的水蒸气
(5)将收集到的气体验纯后点燃,火焰呈淡蓝色,在火焰上方罩一干冷烧杯,烧杯内壁有小液滴出现,证明收集到的气体是氢气
本题解析:
本题难度:一般
3、实验题 (12分)同学们课外探究酸的性质活动中将以下8个实验分为三组进行(如下图所示)。
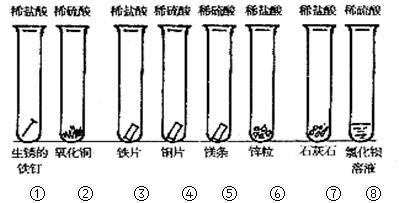
(1)这8个实验是如何分组的?请写出各组的试管编号:
第一组?第二组?第三组?,
你认为如此分组的依据是:?。
(2)写出试管②⑤的实验现象及有关的离子方程式:
②?;? 。
。
⑤?;?。
(3)请作为课外活动小组成员,根据实验及现象的分析、比较,归纳出的结论(至少答3条):
①_________________________________________________;
②_________________________________________________;
③__________________________________________________。
参考答案:(1)(5分)第一组①②;第二组③④⑤⑥;第三组⑦⑧;(各1分)?因为本实验的目的是研究强酸(盐酸和硫酸)分别与金属氧化物、金属、盐的反应 ,所以如此分类。(2分)
,所以如此分类。(2分)
(2) (共4分,现象各1分、离子方程式各1分)
②?固体溶解,得到蓝色的溶液 ;? CuO+2H+=Cu2++H2O。
⑤?镁条溶解,产生大量气体?; Mg +2H+=Mg2++H2↑.
(3)(共3分写出其中三个点给满分)
①酸能跟某些金属氧化物反应;②酸能跟某些盐反应;③酸能跟多种活泼金属反应;
④酸并不能跟所有金属反应;⑤酸与活泼金属反应时速度不同
本题解析:略
本题难度:一般
4、简答题 下列是与硫元素相关的一系列实验,根据下图所示实验回答下列问题:

(1)试管C口部的棉团上发生反应的离子方程式是______
(2)反应一段时间后,停止反应,将B试管中的溶液加热,可以观察到______.试管C中溶液变浑浊,则证明SO2具有______?性.
(3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是______,如果浸NaHCO3溶液,则发生反应的化学方程式是______.
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是______
(5)如果反应过程中要立即停止反应,最简单的方法是______.
参考答案:(1)A中使铜与浓硫酸在加热条件下反应生成了二氧化硫气体,通过BC后,由于二氧化硫是大气污染气体,不能排放到大气中,需要进行尾气处理吸收,所以浸氢氧化钠溶液的棉花团是吸收二氧化硫的作用,反应离子方程式为SO2+2OH-=SO32-+H2O,故答案为:SO2+2OH-=SO32-+H2O;
(2)二氧化硫通过盛品红的B试管,红色褪去,说明了二氧化硫的漂白性,二氧化硫的漂白作用是二氧化硫生成的亚硫酸与品红结合成不稳定的无色物质,加热会恢复红色;试管C中溶液变浑浊是因为发生了反应2H2S+SO2=3S↓+2H2O,反应中二氧化硫做氧化剂,故答案为:溶液由无色变成红色;氧化;
(3)试管C口部的棉团浸NaHCO3溶液,是利用碳酸氢钠溶液的碱性和酸性氧化物二氧化硫反应,吸收污染气体,防止污染大气,反应的化学方程式为NaHCO3+SO2=NaHSO3+CO2 (或2NaHCO3+SO2=Na2SO3+2CO2↑+H2O)
故答案为:吸收有害气体,防止污染空气;NaHCO3+SO2=NaHSO3+CO2 (或2NaHCO3+SO2=Na2SO3+2CO2↑+H2O);
(4)将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,是因为二氧化硫不与氯化钡溶液反应,通入的气体需要满足把二氧化硫转化为盐或把二氧化硫氧化为硫酸,如碱性气体NH3、做氧化剂的气体如Cl2、O2、O3、NO2、Cl2O等,要求填二种化合物和二种单质的化学式;故答案为:NH3 NO2 Cl2 O2;
(5)当铜丝脱离硫酸溶液时反应即可停止,可将抽动铜丝到液面上,故答案为:抽动铜丝到液面上.
本题解析:
本题难度:一般
5、实验题 某校化学课外小组设计了如右图所示的实验装置,进行钠跟水的反应实验,并收集、检验生成的气体。请回答下列问题:(1)关闭活栓A,打开右边的胶塞,先往U形管中加入约4/5体积的水,再加入约1/5体积的煤油,向煤油中加入一小块钠,立即塞好胶塞,反应开始前金属钠的位置在?(填“a”、 “b”或“c”)处。

(2)反应后,钠在煤油层和水层界面之间上下跳动,反应平缓连续进行。试说明产生上述现象的原因:?。
参考答案:(1) a ?(2)钠的密度大于煤油小于水,当钠跟水反应剧烈时, H2气流将钠托入煤油层中,反应停止.随着氢气流减少,钠沉到煤油层和水层的界面,反应又进行
本题解析:略
本题难度:简单