1、填空题 在763 K和3.04×104kPa时,用CO与H2合成CH3OH:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(1)设起始时,n(H2)∶n(CO)=m,平衡时CO转化率为α,CH3OH的体积分数为y,则m、α、y三者的关系是___________。
(2)将下表已知数据代入上述关系,进行计算,将结果填入表中:
?(3)根据表中数据,可得出最佳反应物的配比m是_________,原因是______________。
参考答案:(1)y=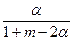 ×100%
×100%
(2)16.67%? 21.43%? 0.56
(3)2当m=2时,平衡气体中CH3OH的体积分数最大
本题解析:(1)设开始时CO为1 mol,则H2为m mol,
由:? CO+?2H2 ?CH3OH
?CH3OH
n始/mol:1?m?0
n变/mol:α?2α?α
n平/mol:1-αm-2α?α
平衡时n(总)=(1+m-2α)mol,
故y=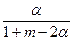 ×100%。
×100%。
(2)直接代入(1)式进行计算得:16.67%、21.43%、0.56。
(3)由(2)知当m=2时,为最佳配比。
本题难度:简单
2、填空题 (1)炭在火炉中燃烧得很旺时,在往炉膛底内的热炭上喷洒少量水的瞬间,炉子内的火会更旺这是因为____________________。
(2)如果欲使炉内炭更充分燃烧,下列措施可行的是_____。
A.向炉内吹空气
B.把块状煤碾碎
C.使用H2O作催化剂
D.提高炉膛内的温度
参考答案:(1)炭与水反应生成CO和H2,燃烧更快,火焰更旺
(2)AB
本题解析:
本题难度:一般
3、选择题 为探究锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入某些物质,下列判断正确的是
A.加入NH4HSO4固体,v(H2)不变
B.加入少量水,v(H2)减小
C.加入CH3COONa固体,v(H2) 不变
D.滴加少量CuSO4溶液,v(H2)减小
参考答案:B
本题解析:硫酸氢钠溶于水电离出氢离子,氢离子浓度增大,反应速率增大,A不正确;稀释降低氢离子的浓度,反应速率降低,B正确;醋酸钠能结合氢离子,降低氢离子的浓度,反应速率降低,C不正确;D中锌可以置换出铜,从而构成原电池,加快反应速率,D不正确,答案选B。
点评:该题是基础性试题的考查,侧重对学生教材基础知识的检验和训练,难度不大。该题的关键是明确外界条件是如何影响反应速率的,如何结合题意灵活运用即可。有利于调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力。
本题难度:一般
4、选择题 已知某可逆反应:mA(g)+nB(g)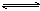 r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是
r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是
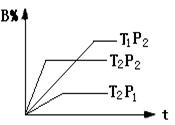
A.T1>T2,p1>p2,m+n>r,正反应吸热
B.T1<T2,p1<p2,m+n<r,正反应吸热
C.T1>T2,p1>p2,m+n<r,正反应放热
D.T1<T2,p1<p2,m+n>r,正反应放热