| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《化学平衡常数》高频试题特训(2020年最新版)(六)
 参考答案:B 本题解析: 本题难度:简单 2、填空题 有体积相等的甲、乙两个密闭容器,如图1所示,甲的活塞可以随意推拉,乙为恒容.向甲容器中充入等物质的量的气体A和B,一定温度下发生反应,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时问变化的曲线如图2所示. 参考答案:(1)0~20?min内A的浓度减少了1mol/L,故v(A)=1mol/L20min=0.05mol/(L?min),故答案为:0.05mol/(L?min); 本题解析: 本题难度:一般 3、选择题 有一反应:2A+B?2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( ? ) |

参考答案:B
本题解析:
本题难度:一般
4、选择题 已知:4NH3(g)+5O2(g)═4NO(g)+6H2O(g),△H=-1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是( ? )
A.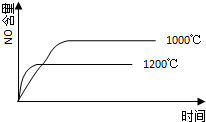
B.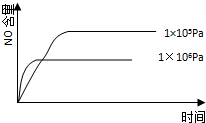
C.
D.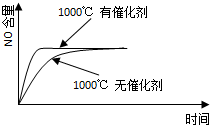
参考答案:C
本题解析:
本题难度:简单
5、填空题 与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:
(1)N的电极反应式为______.
(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气______L(标准状况下).
(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇______?g.
(4)工业上可以利用下列反应制取乙醇:
反应I:2CO2(g)+6H2(g)
? |
? |
温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 1.5 45 33 20 12 2 60 43 28 15 3 83 62 37 22 |
参考答案:(1)燃料电池中,通入燃料的电极是负极,通入氧气的电极是正极,所以N极是电解池的阳极,放电的是电解质中的氢氧根离子,即4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)乙池中M极是阴极,该极上析出金属铜,电极反应为:Cu2++2e-=Cu,当生成金属铜6.4g即0.1mol时,转移电子为0.2mol,甲池和乙池是串联电路,电路中转移电子的量相等,根据甲池中氧气的放电反应O2+2H2O+4e-=4OH-,当转移0.2mol电子时,消耗氧气的物质的量为0.05mol,体积是0.05mol×22.4L/mol=1.12L,,故答案为:1.12;
(3)乙池中阳极反应是4OH--4e-=O2↑+2H2O,阴极反应依次是:Cu2++2e-=Cu,2H++2e-=H2,当铜离子全部放电时,转移电子是0.6mol,设转移nmol电子时,两极上产生气体的体积相等,则两极上产生气体的物质的量等式表示为:0.25n=0.5(n-0.6),解得n=1.2,根据反应C2H6O+3O2=2CO2+3H2O,在转移,12mol电子时,消耗C2H6O的量为1mol,当转移1.2mol电子时,理论上消耗乙醇0.1moL,质量是4.6g,故答案为:4.6;
(4)①平衡常数K=生成物平衡浓度系数次方的乘积反应物平衡浓度系数次方的乘积=[C2H6O][H2O]3[CO2]2[H2]6?,故答案为:[C2H6O][H2O]3[CO2]2[H2]6?;
②根据平衡常数表征的意义:K越大表示反应物的转化程度大,故答案为:反应II;
③根据表中的数据可以看出,温度越高,二氧化碳的转化率越小,所以平衡越往左移动,说明向左的方向是吸热的,即反应是放热,温度越高K越小,根据表中数据提高氢碳比n(H2)/n(CO2),二氧化碳的转化率增大,所以向右进行,有利于乙醇的生成,故答案为:减小,有利.
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《同分异构体.. | |