1、选择题 25°C时,在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的是:
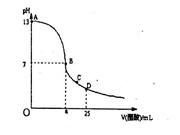
A.在A、B间任一点,溶液中一定都有c(Na+)﹥c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点:c,( CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+ )
参考答案:B
本题解析:略
本题难度:简单
2、填空题 10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化
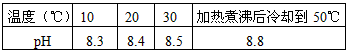
(1)甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为________________。
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
__________(填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:
(3)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则_________(填“甲”或“乙”)判断正确。试剂X是____________。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(4)将加热后的溶液冷却到10℃,若溶液的pH_______(填“高于”、“低于”或“等于”)8.3,则
_______(填“甲”或“乙”)判断正确。
(5)常温下,在测得PH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH-浓度分别为amol/L和
bmol/L,则a与b的关系:________________。
参考答案:(1)HCO3-+H2O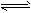 H2CO3+OH-
H2CO3+OH-
(2)大于
(3)乙;B
(4)等于;甲
(3)a=10-4b
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是(设NA为阿伏加德罗常数的数值)
A.检验溶液中是否含有Fe2+的方法是先滴加氯水,再滴加KSCN溶液
B.铅蓄电池放电时的负极反应式为:PbO2+4H++SO42一+2e一=PbSO4+2H2O
C.Na2CO3溶液加水稀释后,恢复至原温度,溶液的pH和Kw均减小
D.某电池的总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,每生成lmolNa2Mn5O10转移电子数2NA
参考答案:D
本题解析:A、亚铁离子具有还原性,所以检验溶液中是否含有Fe2+的方法是先滴加KSCN溶液无现象,再滴加氯水,溶液变成红色,A不正确;B、原电池中负极失去电子,正极得到电子,所以铅蓄电池放电时的正极反应式为PbO2+4H++SO42一+2e一=PbSO4+2H2O。负极反应式为Pb-2e-+SO42-=PbSO4,B不正确;C、碳酸钠溶于水CO32-水解,溶液显碱性。稀释促进水解,但溶液的pH降低。温度不变,Kw不变,C不正确;D、根据反应式可知,二氧化锰是氧化剂,银是还原剂,化合价从0价升高到+1价,所以每生成lmolNa2Mn5O10转移电子数2NA,D正确,答案选D。
本题难度:一般
4、选择题 常温下,0.1 mol·L-1的HA溶液中c(OH-)/c(H+)=1×10-8,下列叙述中正确的是
A.0.01mol·L-1 HA的溶液中c(H+)=1×10-4 mol·L-1
B.pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得溶液中c(Na+)>c(A-)>c(OH-)>c(H+)
C.pH=3的HA溶液与pH=11的NaO H溶液按体积比l:10混合后所得溶液中c(OH-)+c(A-)=c(H+)+c(Na+)
D.浓度均为0.1 mol·L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(OH-)-c(H+)<c(HA)-c(A-)
参考答案:C
本题解析:根据题意知,常温下,0.1 mol·L-1的HA溶液中c(OH-)/c(H+)=1×10-8,而Kw=c(H+)c(OH-)=10-14,则溶液中氢离子浓度为0.001mol·L-1,则HA为弱酸; A、HA为弱酸,加水稀释,促进电离,0.01mol·L-1 HA的溶液中c(H+)>1×10-4 mol·L-1,错误;B、HA为弱酸,pH=3的HA溶液与pH=11的NaOH溶液等体积混合后HA远远过量,所得溶液中c(A-)>c(Na+)>c(H+)>c(OH-),错误;C、根据电荷守恒判断,pH=3的HA溶液与pH=11的NaO H溶液按体积比l:10混合后所得溶液中c(OH-)+c(A-)=c(H+)+c(Na+),正确;D、浓度均为0.1 mol·L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则HA的电离程度大于NaA,则c(H+)- c(OH-)-<c(A-)-c(HA),错误。
本题难度:一般
5、选择题 向CH3COONa稀溶液中分别加入少量下列物质或改变如下条件,一定能使比值c(CH3COO-)/c(Na+)减小的是
[? ]
①固体NaOH ②固体KOH ③固体NaHSO4 ④固体CH3COONa ⑤冰醋酸 ⑥降温
A.②④⑤⑥
B.①③④
C.只有①③
D.③④⑥
参考答案:C
本题解析:
本题难度:一般