1、选择题 某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度,有关叙述正确的是(? )
A.H2Y在电离时:H2Y+H2O HY-+H3O+
HY-+H3O+
B.在该盐的溶液中,离子浓度为:c(Na+)>c(HY-)>c(Y2-)>c(OH-)>c(H+)
C.在该盐的溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
D.HY-水解方程式为:HY-+H2O Y2-+H3O+
Y2-+H3O+
参考答案:A
本题解析:由于HY-的电离程度小于HY-的水解程度,故溶液呈碱性,且H2Y是弱酸,则H2Y在电离时:H2Y+H2O HY-+H3O+;HY-水解方程式为:HY-+H2O
HY-+H3O+;HY-水解方程式为:HY-+H2O H2Y+OH-;在该盐的溶液中,离子浓度为:c(Na+)>c(HY-)>c(OH-)>c(Y2-)>c(H+)。
H2Y+OH-;在该盐的溶液中,离子浓度为:c(Na+)>c(HY-)>c(OH-)>c(Y2-)>c(H+)。
本题难度:一般
2、填空题 (1)已知在常温下测得浓度均为0.1 mol/L的下列5种溶液的pH:
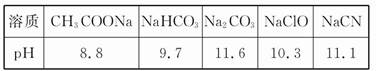
根据上述信息判断,浓度均为0.05 mol/L的下列5种物质的溶液中,pH最小的是?(填编号);其pH为?(填数值);pH最大的是?(填编号)。
①CH3COOH?②HCN?③HClO ?④H2SO4?⑤HClO4
(2)下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液。
②在侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体。
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体。
根据上述反应,总结出复分解反应发生的一个规律:?;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是?,
请写出反应的离子方程式:?。
参考答案:(1)④? 1?②
本题解析:(1)5种溶液中H2SO4、HClO4为强酸,相同浓度时H2SO4的pH最小,pH=-lg(2×0.05)=1。pH最大的即酸性最弱的,根据“酸越弱越水解”并结合题干信息,相同浓度时NaCN碱性强,则对应的HCN的酸性最弱,pH最大。因CO32-对应酸为HCO3-,此处易将Na2CO3溶液碱性更强误认为H2CO3酸性最弱。
(2)从题给3个转化可以看出,反应之所以能够发生,是因为生成溶解度更小的物质。因AgI的溶解度小于AgCl,白色沉淀AgCl能够转化为黄色沉淀AgI
本题难度:一般
3、选择题 根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
化学式
| 电离常数
|
HClO
| K=3×10-8
|
H2CO3
| K1=4.3×10-7
|
K2=5.6×10-11
|
A.c(HCO3-)>c(ClO-)>c(OH-)
B.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+C(OH-)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)
D.c(Na+)=c(HCO3-)+ c(CO32-) + c(H2CO3) +c(ClO-) +c(HClO)
参考答案:A
本题解析:c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+C(OH-) + 2c(CO32-)
c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+ c(CO32-)
2c(Na+)=c(HCO3-)+ c(CO32-) + c(H2CO3) +c(ClO-) +c(HClO)
本题难度:简单
4、选择题 已知HCN的电离常数K=6.2×10-10。用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,经测定溶液呈碱性。则下列关系式正确的是
A.c(CN-)>c(Na+)
B.c(CN-)<c(HCN)
C.c(HCN)+ c(CN-)=0.2mol·L-1
D.c(CN-)+ c(OH-)=0.1mol·L-1
参考答案:BC
本题解析:略
本题难度:一般
5、选择题 实验中在对某种样品进行检验时,加入试剂顺序的不同对最后结果的判断具有很大影响。某样品中可能含有SO42-,实验中加入试剂种类和顺序正确的是(? B )
A.BaCl2溶液,稀盐酸?B.稀盐酸,BaCl2溶液
C.BaCl2溶液,稀硝酸?D.稀硝酸,BaCl2溶液
参考答案:B
本题解析:A、C、D中分别难排除银离子、银离子、亚硫酸根等的干扰
本题难度:一般