1、计算题 室温时,若0.1mol·L-1NaX溶液的pH=9,该溶液中发生水解反应的X-占全部X-的物质的量分数为多少?
参考答案:0.01%
本题解析:pH=9,则c(OH-)=10-5mol·L-1,设溶液体积为1L,水解的X-物质的量为x,由水解方程式知:
X-+H2O HX+OH-
HX+OH-
x=n(OH-)=10-5mol
所以发生水解反应的X-占全部X-的物质的量分数为:
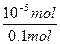 ×100%=0.01%
×100%=0.01%
本题难度:简单
2、选择题 一定量的(NH4)2SO4与NH3·H2O混合所得的碱性溶液中,下列说法错误的是
A.c(OH–) > c(H+)
B.c(NH4+) + c(H+) = 2c(SO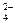 )+ c(OH–)
)+ c(OH–)
C.c(NH4+)<2c(SO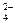 )
)
D.c(NH4+)> 2c(SO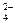 )
)
参考答案:C
本题解析:略
本题难度:一般
3、填空题 (12分)孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如下图。
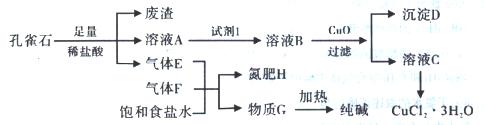
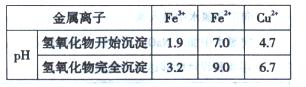
且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如表所示。回答下列问题:
(1)图中“试剂1”为? ?。
?。
(2)加入CuO作用是调节溶液pH,则pH的范围为?。
(3)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通人饱和食盐水中。其中,应先通入气体是?(填代号及对应物质的化学式)
(4)由溶液C获得CuCl2·3H2O,需要经过?、?、过滤等操作。
(5)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O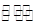 Cu(OH)2+2H+反应平衡常数?。
Cu(OH)2+2H+反应平衡常数?。
参考答案:

本题解析:略
本题难度:一般
4、选择题 对下列各溶液中,微粒的物质的量浓度关系表述正确的是(?)
A.0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.0.1mol·L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C.将0.2mol·L-1NaA溶液和0.1mol·L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.在25℃时,1mol/L的Na2S溶液中:c(OH-)= c(H+)+c(HS-)+2c(H2S)
参考答案:D
本题解析:NH4+水解显酸性,但其水解程度是很弱的,所以正确的顺序是c(NH4+)>c(SO42-)> c(H+)>c(OH-),A不正确。根据碳原子守恒可知c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),B不正确。根据电荷守恒可知c(Na+)+c(H+)=c(A-)+c(Cl-)+(OH-),C不正确。D中符合质子守恒,是正确的。答案选D。
本题难度:一般
5、选择题 下列是有关0.1 mol/L醋酸钡[(CH3COO)2Ba]溶液微粒浓度的比较,其中错误的是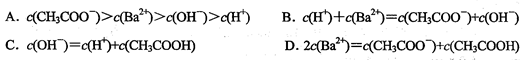
参考答案:
B
本题解析:
本题考查电解质溶液中离子浓度大小的比较,关键要应用好溶液中的三大守恒——物料守恒、电荷守恒、质子守恒。CH3COO一在水中发生水解生成CH3COOH, c (CH3COO)减小,但分比c(Ba2+)大,水解后溶液呈碱性,C(OH一) >C(H+),故A正确,由溶液中的电荷守恒,2c(Ba2+) + C(H+)=c(CH3COO一)+ C(OH一),B错;由水的电离的质子守恒,有C(OH一) = C(H+)+CH3COOH,C正确;由醋酸钡的物料守恒,有2c(Ba2+)= c(CH3COO一)+CH3COOH,D正确;
本题难度:一般