微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:Ksp(RCl)=1.8×10-10,Ksp(RI)=1.5×10-16,Ksp(R2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,R+浓度大小顺序正确的是
[???? ]
A.RCl>RI>R2CrO4
B.RCl>R2CrO4>RI
C.R2CrO4>RCl>RI
D.R2CrO4>RI>RCl
参考答案:C
本题解析:
本题难度:一般
2、填空题 已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用:

请回答下列问题:
(1)在上图的括号内应填的是在_______________环境中加热。
(2)Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固)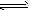 Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________有利于Mg(OH)2溶解。
(3)已知AnBm的离子积=c (Am+) n ·c (Bn-) m,式中c (Am+) n和c (Bn-) m表示离子的物质的量浓度,某温度时若测得Mg(OH)2饱和溶液的pH值为11,其离子积为___________________。
(4)依据绿色化学的原子经济的概念(即化学反应的原料中每个原子都参与反应并全部转化为产物),203kgMgCl2·6H2O原料可以获得29.8kg MgO、___________kg36.5%的盐酸和___________kg MgCl2。
参考答案:(1)HCl气流
(2)酸、水、酸性气体、饱和NH4
本题解析:
本题难度:一般
3、选择题 已知,常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17,下列叙述中,正确的是[???? ]
A. 向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色
B. 常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小
C. 将0.001 mol·L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀
D. 向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-)
参考答案:A
本题解析:
本题难度:一般
4、填空题 (16分)
(1)等物质的量的A和B,混合于2L的密闭容器中,发生反应3A(g)+B(g)=xC(g)+2D(g),经过5min时,测得D的浓度为1mol/L,c(A):c(B)=3:4,C的反应速率是0.2mol?L-1?min-1,A在5min末的浓度是______,x的值是______.
(2)1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图(各物质为气体)
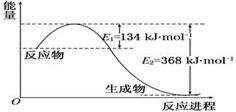
写出NO2和CO反应的热化学方程式____________________
(3)已知可逆反应:M(g)+N(g)  P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1, c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为____
②平衡后,升高温度,平衡常数 。(增大、减小)
(4)t ℃时,水的离子积常数为1×10-13,则该温度 25℃(填大于,小于)。若将此温度下PH=11的苛性钠溶液a L与PH=1的稀硫酸b L混合(忽略混合后体积变化),若所得混合液为中性,则a :b= 。
(5)已知298K时, Ksp(CaCO3)=2.80×10-9, Ksp(CaSO4)=5.6×10-5 ,求此温度下该反应 的平衡常数K的数值为____
的平衡常数K的数值为____
参考答案:(1)3 mol/L,x=2(2)NO2(g)+CO(g)=
本题解析:
试题分析:(1)假设AB的物质的量为n,D的浓度为1mol/L,所以D的物质的量为2摩尔,则列式计算:
3A(g)+B(g)=xC(g)+2D(g)
起始物质的量 n n 0 0
改变物质的量 3 1 x 2
5分末的物质的量 n-3 n-1 x 2
(n-3)/(n-1)=3/4 解n=9摩尔, x÷2÷5=0.2 x=2,所以A在5分末的浓度为(9-3)/2="3" mol/L,x=2。(2)根据图像分析1摩尔二氧化氮和1摩尔一氧化碳反应放热为364-134=234kJ的热量,热化学方程式写为:NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234 kJ·mol-1。(3)①M的转化率为60%,则反应的M的物质的量浓度为1×60%=0.6 mol·L-1,根据反应方程式分析,N反应的物质的量浓度也为0.6 mol·L-1,则N的转化率=0.6/2.4=25%。②由于正反应为吸热,所以升温平衡正向移动,平衡常数增大。(4)因为常温下水的离子积常数为10-14,电离吸热,常数增大,说明平衡正向移动,温度升高,即温度大于25℃。在此温度下,pH=11的氢氧化钠溶液中氢氧根离子浓度=0.01 mol?L-1,pH=1的硫酸溶液中氢离子浓度为0.1 mol?L-1,弱酸碱混合后为中性,则氢离子和氢氧根离子物质的量相等,即体积比为10:1。(5)该反应的平衡常数=c(SO42-)/c(CO32-)= Ksp(CaSO4)/ Ksp(CaCO3)= 5.6×10-5/2.80×10-9=2×104。
考点:化学平衡计算,热化学方程式书写,化学平衡常数,酸碱混合。
本题难度:困难
5、填空题 工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:

已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
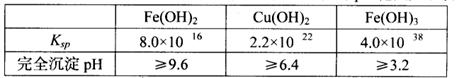
(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,写出其反应的化学方程式: ;
(2)试剂X的化学式为 ;
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ,用pH试纸测该溶液pH值的方法是 ;
(4)在溶液N中加入乙醇的目的是 。
参考答案:(1)2CuFeS2+O2 本题解析:
本题解析:
试题分析:(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,即Cu2S和2FeS,由S元素守恒,S元素有多余,与O2结合为SO2。(2)B溶液含Cu2+和Fe3+,为了除去Fe3+,可以降低溶液的pH至3.2到6.4之间,试剂X的化学式为CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3等;(3)试剂Y是氨水,0.1 mol/L时pH=11,c(OH-)≈c(NH4+)=10-3;NH3·H2O的电离常数为K=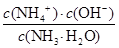 =10-5;(4)用pH试纸测该溶液pH值的方法是用洁净的玻璃棒蘸取待测液点在pH试纸的中央,并与比色卡比色;(4)在溶液N中加入乙醇的目的是降低晶体溶解度,有利于晶体析出。
=10-5;(4)用pH试纸测该溶液pH值的方法是用洁净的玻璃棒蘸取待测液点在pH试纸的中央,并与比色卡比色;(4)在溶液N中加入乙醇的目的是降低晶体溶解度,有利于晶体析出。
考点:化学方程式的书写即实验基本操作。
本题难度:困难