微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (11分)(2011·滨州模拟)Ⅰ.回答下列有关常数的问题:
(1)Kw的数学表达式是________,温度升高Kw________(选填“变大”“变小”或“不变”),若定义pOH=-lgc(OH-),则pH+pOH=________(用含Kw的代数式表示)。
(2)Ka通常表示弱酸的电离平衡常数,Ka值越大表示该弱酸的酸性________。α通常称为电离度,顾名思义是表示弱电解质的电离程度大小的一个指标,对于某一元弱酸,当用蒸馏水稀释该酸时,Ka________(选填“变大”“变小”或“不变”)。α________(选填“变大”“变小”或“不变”)。
(3)Ksp表示难溶物的溶度积常数,该常数越大表示________。
Ⅱ.已知常温下,AgBr的Ksp=4.9×10-13mol2·L-2、AgI的Ksp=8.3×10-17mol2·L-2。
(1)现向含有AgI的饱和溶液中:
①加入固体AgNO3,则c(I-)________(填“变大”“变小”或“不变”,下同);
②若改加更多的AgI,则c(Ag+)________;
③若改加AgBr固体,则c(I-)______;而c(Ag+)______。
(2)有关难溶盐的溶度积及溶解度(与AgBr、AgI无关),有以下叙述,其中正确的是________。
A.两种难溶盐电解质,其中Ksp小的溶解度一定小
B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解又达到平衡时,AgCl的溶度积不变,其溶解度也不变
C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
D.溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉淀
E.难溶盐电解质的Ksp与温度有关
F.同离子效应(加入与原电解质具有相同离子的物质),使难溶盐电解质的溶解度变小,也使Ksp变小
(3)现向含有NaBr、KI均为0.002 mol·L-1的溶液中加入等体积的浓度为4×10-3 mol/L AgNO3溶液,则产生的沉淀是________(填化学式);若向其中再加入适量的NaI固体,则最终可发生沉淀转化的总反应方程式表示为:______________________________。
参考答案:Ⅰ.(1)c(H+)·c(OH-)"变大"-lg Kw
本题解析:Ⅰ.考查水的电离、弱电解质电离以及难溶电解质溶解平衡。
Ⅱ.(1)AgI(s)??Ag+(aq)+I-(aq);Ag+浓度增大,溶解平衡向左移动,c(I-)减小,若加入溶解性较大的AgBr则
c(Ag+)增大,c(I-)将会减小。
(2)难溶盐组成不同,Ksp小溶解度不一定小故A错;C项,应该是离子浓度幂的乘积;D项,看盐组成形式;F项Ksp只与温度有关,故C、D、F均错。
本题难度:困难
2、填空题 (12分)皮革工业污泥中含较多的Cr,工业采用以下工艺制得M[Cr(OH)(H2O)5SO4]。
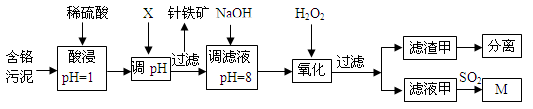
已知:①工艺中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+。
②常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
阳离子
| Fe3+
| Al3+
| Cu2+
| Mg2+
| Cr3+
|
开始沉淀时的pH
| 1.9
| 3.7
| 4.7
| 9.3
| ---
|
沉淀完全时的pH
| 3.2
| 8.0
| 6.7
| 11.1
| 9(>9溶解)
(1)酸浸时,为了提高浸取效率可采取的措施是________________(任写一条)。
(2)调节pH所用X可以选用 。
A.NaOH B.Na2CO3 C.H2SO4 D.HNO3
(3)加入H2O2 目的是把Cr(OH)3沉淀转化为Cr2O72-,写出该反应的离子方程式 。针铁矿组成元素是Fe、H、O,化学式量为89,其化学式是______________。
(4)调滤液至pH=8,Al3+、Cu2+、Mg2+中的_________将转化为沉淀。
(5)若滤液甲的pH=a,则溶液中c (Cu2+)= 。(25℃时的Ksp[ Cu(OH)2]=2.2×10-20)
参考答案:(1)升温或搅拌或多次浸取货适当延长酸浸时间或适当提高酸的浓
本题解析:
试题分析:(1)酸浸时,为了提高浸取效率,可改变条件为温度、浓度、接触面积、接触时间等,故采取的措施是升温或搅拌或多次浸取货适当延长酸浸时间或适当提高酸的浓度等;(2)加入X调节pH升高目的是为了使Fe3+形成沉淀,故可用试剂为NaOH或Na2CO3,故选AB;(3)加入H2O2 目的是把Cr(OH)3沉淀转化为Cr2O72-,写出该反应的离子方程式2Cr(OH)3+2H2O2+2OH—=Cr2O72—+7H2O;针铁矿组成元素是Fe、H、O,化学式量为89,其化学式是Fe0(OH);由图表可知调滤液至pH=8,Al3+、Cu2+、Mg2+中的Al3+、Cu2+均转化为沉淀;(5)若滤液甲的pH=a,则溶液中c (Cu2+)= =2.2×108-2amol/L。 =2.2×108-2amol/L。
考点:化学工艺流程。
本题难度:困难
3、选择题 25℃时,Fe(OH)3的Ksp=4×10-38,若使某溶液中Fe3+完全沉淀所需pH最接近
A.3
B.7
C.9
D.11
参考答案:A
本题解析:
试题分析:当Fe3+小于等于10-5mol/L时认为沉淀完全,则C(OH-?)= = =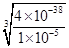 =1.59×10-11m =1.59×10-11m
本题难度:一般
4、选择题 下列说法正确的是(????)
A.水垢的主要成分是MgCO3和CaCO3
B.硬水的软化是将全部的Mg2+、Ca2+除尽
C.加入FeS、MnS以除去工业废水中的Cu2+、Cd2+、Pb2+等重金属离子
D.胃舒平的主要成份是氢氧化铁,可治疗胃酸过量,同时也可补铁。
参考答案:C
本题解析:由于持续加热,将MgCO3转化成更难溶的Mg(OH)2,故水垢的主要成分是Mg(OH)2和CaCO3。硬水的软化:除去其中少量的Mg2+、Ca2+,并非一定要除尽,而只是尽量降低它们的浓度。加入FeS、MnS是将废水中的Cu2+、Cd2+、Pb2+等重金属离子转化成更难溶的沉淀CuS、CdS、PbS而除去。胃舒平的主要成份是氢氧化铝,可治疗胃酸过量。
本题难度:简单
5、选择题 已知25℃时3种难溶电解质的溶度积:AgCl?? 1.8 ×10-10;AgI?? 1.5×10-16;Mg(OH)2? 1.8 ×10-11。在25℃上述3种难溶电解质各自的饱和溶液中,下列判断正确的是
A.AgCl饱和溶液中c(Ag+)比AgI饱和溶液中c(Ag+)大
B.AgCl饱和溶液中c(Ag+)比Mg(OH)2饱和溶液中c(Mg2+)大
C.将AgCl与AgI的饱和溶液等体积混合,再加入足量浓AgNO3溶液,则发生的反应为:AgCl与AgI沉淀都有,但以AgI沉淀为主。
D.若往AgCl饱和溶液中加入0.1 mol/LKI溶液,有黄色沉淀产生
参考答案:AD
本题解析:考查溶度积常数的应用。难溶电解质达到溶解平衡时,电解质电离出的离子的浓度的幂之积,称为溶度积常数。氯化银的溶度积常数大于碘化银的,所以AgCl饱和溶液中c(Ag+)比AgI饱和溶液中c(Ag+)大,A正确。AgCl饱和溶液中c(Ag+)=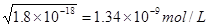 ,Mg(OH)2?饱和溶液中c(Mg2+)= ,Mg(OH)2?饱和溶液中c(Mg2+)= 本题难度:一般 本题难度:一般
|