微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
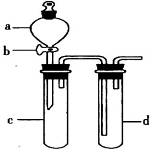
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是________________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是______________________________。再由a向c中加2mL蒸馏水,c中的实验现象是_______________________________。
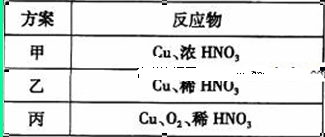
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____________,理由是_____________________________________。
(4)该小组同学向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸。观察到的实验现象是________________________;该小组同学实验目的是_________________,但此实验的不足之处是_____________________________。
参考答案:(1)检查装置气密性(2)Cu+4HNO3(浓)=Cu(NO
本题解析:
试题分析:(1)因实验前要检查装置气密性,这是检查装置气密性的常见方法,故答案为:检查装置气密性;(2)因铜与浓硝酸反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,由a向c中加2mL蒸馏水,硝酸进行的稀释,反应变缓,同时因二氧化氮能与水反应:3NO2+2H2O=2HNO3+NO,c中气体颜色变浅,故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;反应变缓,气体颜色变淡;(3)铜与浓硝酸制取硝酸铜时的方程式是:Cu+4HNO3(浓)=Cu(NO3)2+2
本题难度:一般
2、选择题 木炭屑与浓HNO3共热产生的气体等分为①和②两份。第一份先导入适量的蒸馏水再导入澄清石灰水;第二份直接导入澄清的石灰水,则石灰水的变化可能是(???)
A.①不变浑浊,②变浑浊
B.①变浑浊,②不变浑浊
C.①和②都变浑浊
D.①和②都始终未见浑浊
参考答案:B
本题解析:木炭与浓HNO3反应产生的气体为CO2和NO2,第一份通过蒸馏水后,3NO2+H2O====2HNO3+NO,混合气体变为CO2和NO,再通过澄清石灰水,Ca(OH)2+CO2====CaCO3↓+H2O,溶液变浑浊。而第二份直接通入澄清石灰水,产生的CaCO3沉淀又被HNO3(NO2与H2O反应产生的)溶解,故不变浑浊。
本题难度:简单
3、填空题 选择性催化还原(SCR)是在有催化剂的条件下将NOx 转变为N2和H2O,这是目前国外硝酸厂进行尾气治理所普遍采用的一种方法。

某校甲、乙两个化学兴趣小组拟验证NO能被氨气还原并测算其转化率。
(一)甲组拟制取活性亚铬酸铜催化剂
亚铬酸铜(Adkin催化剂)是极好的NO催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:CuO·Cr2O3等,统称为亚铬酸铜。该组同学取一定量硝酸铜溶液(并加少量硝酸钡作稳定剂)、 重铬酸铵溶液与氨水作用得土黄色沉淀, 将沉淀物[经测定为:碱式铬酸铜铵(CuNH4(OH)CrO4 )]过滤、洗涤,80℃烘干12h, 最后焙烧。
(1)过滤用到的玻璃仪器有:?▲?(选填序号,下同);焙烧用到的仪器有: ??▲?。
A.蒸发皿
B.石棉网
C.泥三角
D.烧杯 E.坩埚钳 F.酒精灯
G.玻璃棒??? H.漏斗?? I.坩埚(部分仪器已略去)
(2)CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,该反应的化学方程式:???????????▲???????????????????。
(二)乙组拟用甲组制得催化剂按下列流程进行实验。

试回答下列问题:
(3)若制取氨气在A装置,则发生反应的化学方程式为:???????▲?????????;
若用B装置制取氨气,则分液漏斗和锥形瓶中盛放的药品分别是:????▲?????。

(4)用图C装置制取NO时,用可抽动的铜丝其优点是:??????▲???????????????;
(5)装置⑦的作用可能是:????????▲????????????。
(6)若进入装置⑤的NO共2688mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下2016mLN2,则NO的转化率为:????????▲?????????。
参考答案:(1)D、G、H ??;?C
本题解析:属于把基本实验知识赋予新情景是常见命题方式。本题属于简单题,(1)(3)两问可直接回答;(2)中需要用到情景中CuO·Cr2O3作为反应的产物,这样本题又考查了氧化还原反应。最后一问解法上利用氮元素守恒:由反应方程式4NH3+6NO=5N2+6H2O可知,当生成2016mL即0.09mol N2时,需要NO 0.108mol
总NO为0.12 mol,所以转化率为90%。
本题 难度:一般
4、填空题 (12分)X、Y、Z、W为常见含有相同电子数的离子或分子,其中X有5个原子核,这些微粒与一氧化氮间有如下转化关系(图中部分反应物、产物及反应条件已略去)。
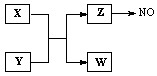
(1)Z →NO反应的化学方程式是:?????????????????????????
液态 Z与水的电离相似,其中存在的电子数相同的两种微粒是????????????????????。
(2)实验室中检验Z的化学试剂及现象是:
?
| ????化学试剂
| ????????现象
|
方法一
| ?
| ?
|
方法二
| ?
| ?
(3)由构成X、Y的三种元素所组成的一种离子化合物,且三种元素原子数之比为2:4:3,该离子化合物是??????????????????(填写化学式)。
(4)一定条件下,Z与一氧化氮或二氧化氮反应均可生成两种很稳定的产物。若有二氧化氮与Z的混合气体20 mL在该条件下反应,实际参加反应的二氧化氮比Z少2 mL,则原混合气体中Z与二氧化氮的体积比是??????????????????。
参考答案:(12分)
(1) 本题解析:本题主要考查了微粒结构、氨气的性质及检验;氧化还原反应的相关知识; 本题解析:本题主要考查了微粒结构、氨气的性质及检验;氧化还原反应的相关知识;
(1)联想常见的10电子微粒,再依题意很容易知道:X为NH4+、Y为OH—、Z为NH3、W为H2O;
(4)4NH3 + 3NO2 =2N2 + 6H2O
设参加反应的NH3为a ml,则参加反应的NO2为3a/4,即a-3a/4=2,a=8。
所以参加反应的NH3为8 ml,NO2为6ml;由于二者共20 ml,很容易算出
NH3过量:NH3为14 ml,NO2为6 ml,二者体积比为7:3
NO2
本题难度:一般
5、填空题 固体硝酸盐加热易分解且产物较复杂。已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下:
I.2KNO3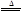 2KNO2+O2↑ 2KNO2+O2↑
II.2Cu(NO3) 2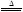 2CuO+4NO2↑+O2↑ 2CuO+4NO2↑+O2↑
III.2AgNO3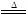 2Ag+2NO2↑+O2↑ 2Ag+2NO2↑+O2↑
(1)某固体可能由KNO3、Cu(NO3)2、AgNO3三种硝酸盐中的一种或几种组成。取适量该固体充分加热,得到一定量气体。若该气体经水充分吸收后,剩余气体的体积在同温同压下为吸收前的1/6。 (忽略氧在水中的溶解)
①若该固体只是由一种盐组成,则该盐为????????????。
②若该固体是混合物,则该混合物的可能组成为?????????????????。
(2)某学习小组以Mg(NO3)2为研究对象,通过实验探究其热分解的产物,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
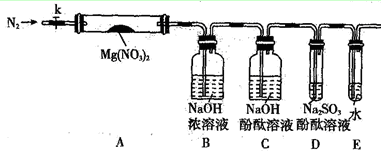
【实验步骤】
a.仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管A。
b.称取Mg(NO3)2固体3.7g置于A中,先通入一段时间N2,再关闭k,用酒精灯加热硬质玻璃管A。
c.待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g。
①步骤a的目的是??????????????????????????????????????????;
②依据已知的三个方程式,再根据剩余固体的质量写出Mg(NO3)2热分解方程式为:?????????????????????。
③若A中固体为AgNO3,用以上实验装置进行实验时,D 中的现象为?????????,用离子方程式表示出现该现象的原因:_____________________?????????。
④从实验安全的角度判断该实验装置有无缺陷?若有,应如何改进???????????????????????????????????????????????????????????????。
参考答案:(1)①AgNO3?(2分)?
②KNO3和Cu(NO
本题解析:
试题分析:(1)①因为4NO2+O2+2H2O=4HNO3, KNO3受热分解生成O2,不能被水吸收;Cu(NO3)2受热分解生成NO2和O2,且V(NO2)∶V(O2)=4∶1,所以其生成的混合气体可全溶于水;AgNO3受热分解生成NO2和O2,且V(NO2)∶V(O2)=2∶1,则当其溶于水时,O2过量,设NO2为 2aL,O2为a L,反应前共3aL,溶于水后剩余O2为:aL- 1/2aL =" 1/2a" L,剩余气体的体积在同温同压下为吸收前的1/6,所以若该固体只是由一种盐组成,为Ag
本题难度:困难
|