微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是???
A.铜铸塑像上出现铜绿[Cu2(OH) 2CO3]
B.灶具大理石板被食醋腐蚀变得不光滑
C.含亚铁离子的补血药丸采用糖衣包裹
D.用煤气灶燃烧天然气为炒菜提供热量
参考答案:B
本题解析:A 2Cu+O2+CO2+H2O=Cu2(OH)2CO3有化合价的变化,是氧化还原反应。
B? CaCO3+2HCl=CaCl2+CO2+H2O??无化合价的变化,与氧化还原反应无关
C? Fe2+有还原性,容易被空气中的氧气氧化,所以,采用糖衣包裹,与氧化还原反应有关。
D? CH4+2O2=CO2+2H2O??有化合价的变化,与氧化还原反应有关
本题难度:简单
2、选择题 多硫化钠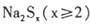 在NaOH溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO的物质的量之比为1:16。Na2Sx在结构上与Na2O2类似。则下列有关说法正确的是
在NaOH溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO的物质的量之比为1:16。Na2Sx在结构上与Na2O2类似。则下列有关说法正确的是
A.Na2Sx中的X数值为2
B. 1 molNa2Sx参加反应,有32mol电子转移
C.Na2Sx含有离子键和极性共价键
D.该反应中Na2Sx是氧化剂,NaClO是还原剂
参考答案:B
本题解析:Na2Sx中的硫元素共升高:6x—(—2)=6x+2价,而NaClO中的氯元素共降低:2×16=32价,故x=5;反应中电子转移为32个;
Na2Sx是还原剂,NaClO是氧化剂
Na2Sx在结构上与Na2O2类似,即属于离子化合物,而阴离子中的硫原子之间是非极性共价键;
答案为B
本题难度:一般
3、选择题 对1 mol·L-1的BaCl2溶液的有关叙述中,正确的是( )
A.该溶液中Cl-浓度为2 mol·L-1
B.该溶液中Ba2+的物质的量是1 mol
C.可使用250 mL容量瓶分两次完成490 mL该浓度的BaCl2溶液的配制
D.将208 g BaCl2固体溶解在1 L水中,形成的溶液的浓度为1 mol·L-1
参考答案:A
本题解析:结合BaCl2=Ba2++2Cl-,Cl-浓度是BaCl2浓度的两倍,A项正确;未指明溶液体积,不能计算溶质的物质的量,B项错误;490 mL溶液需使用500 mL容量瓶一次性配制,C项错误;1 mol·L-1的溶液应是将1 mol溶质溶解在水中形成1 L的溶液,D项错误。
本题难度:简单
4、填空题 (3分)工业上冶炼金属铁的主要反应为:Fe2O3 + 3CO? =" 2Fe" + 3CO2。其中,Fe2O3???? __________(填“被氧化”或“被还原”),CO作_________(填“氧化剂”或“还原剂”)。在该反应中,若消耗了1 mol Fe2O3,则生成__________mol Fe。
参考答案:被还原?还原剂? 2
本题解析:
试题分析:在反应中,氧化铁失去了氧,发生了还原反应,被还原,是氧化剂。碳得到了氧,发生了氧化反应,是还原剂。由反应式可知,氧化铁在反应中失去了氧,发生了还原反应,是氧化剂。根据反应规律,物质反应的量之比等于化学计量数之比,故生成2_mol Fe。
点评:解答本题的关键是要充分理解氧化还原反应的含义,知道氧化剂在反应中提供了氧的特征,只有这样才能对问题做出正确的判断。
本题难度:一般
5、填空题 (4分) 实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
(1)在该反应中,还原剂是 。
(2)若在反应中生成了标况下2.24L氯气,则电子转移的个数是 NA。
参考答案:(1)HCl
本题解析:
试题分析:在2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O中,HCl Cl2,化合价升高,失去电子,作还原剂。每产生5摩尔的Cl2转移电子10摩尔。现在产生氯气的物质的量为0.1mol,转移的电子的个数为0.2NA。
Cl2,化合价升高,失去电子,作还原剂。每产生5摩尔的Cl2转移电子10摩尔。现在产生氯气的物质的量为0.1mol,转移的电子的个数为0.2NA。
考点:考查实验室用高锰酸钾和浓盐酸反应制取氯气的氧化剂、还原剂的判断及电子转移的知识。
本题难度:一般