微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 H2O2是重要的化学试剂,在实验室和生产实际中应用广泛。应用其不稳定性,H2O2可被用来研究催化剂对反应速率的影响。
(1)写出H2O2在MnO2催化下分解的化学方程式:____________________。
(2)H2O2的生产过程要严格避免混入Fe2+和Fe3+,否则会发生如下两个反应,加快其分解,且Fe2+和Fe3+各自的量保持不变。
①2Fe2++H2O2+2H+=2Fe3++2H2O;② _____________(写离子方程式)。
(3)从(1)和(2)分析,在下列哪类元素中寻找H2O2分解的催化剂更有研究价值____________。
a.主族元素 b.过渡元素 c.0族元素
H2O2的水溶液显弱酸性,写出一个用盐酸制取H2O2的化学方程式:_____________。
H2O2在使用中通常不会带来污染。
(4)工业上利用Cl2+H2O2=2HCl+O2除氯,在此反应中被氧化的物质是_____________。
(5)消除某废液中的氰化物(含CN-),完成下列反应:CN-+H2O2+H2O=_______+NH3↑。实验室常用酸性KMnO4溶液测定H2O2的浓度。取10. 00 mL H2O2溶液样品(密度近似为1 g/mL)于锥形瓶中,加水到
50. 00 mL,当滴入0.10mol/LKMnO4溶液40.00 mL后,到达滴定终点。则原样品中H2O2
的质量分数是________。(已知:2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O)
2、选择题 将2 mol NaHCO3和一定量的Na2O2固体混合,在加热的条件下使其反应,经测定无Na2O2剩余,则最后所得固体的物质的量(n)为(???)
A.1mol<n≤2mol
B.1mol<n≤4mol
C.2mol<n≤4mol
D.n>4mol
3、填空题 10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃)
| 10
| 20
| 30
| 加热煮沸后冷却到50℃
|
pH
| 8.3
| 8.4
| 8.5
| 8.8
?
甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为?????????????????????????????。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度?????(填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:___________________________
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则?????(填“甲”或“乙”)判断正确。试剂X是???????。
A、Ba(OH)2溶液??B、BaCl2溶液??C、NaOH溶液??D、澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则???(填“甲”或“乙”)判断正确。
(3)常温下,在测得PH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH—浓度分别为amol /L和bmol /L,则a与b的比值=??????????????????。
4、选择题 用下图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是(???)
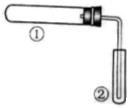
?
| ①中实验
| ②中现象
| A
| 铁粉与水蒸气加热
| 肥皂水冒泡
| B
| 加热NH4Cl和Ca(OH)2混合物
| 酚酞溶液变红
| C
| NaHCO3固体受热分解
| 澄清石灰水变浑浊
| D
| 石蜡油在碎瓷片上受热分解
| Br2的CCl4溶液褪色
5、选择题 一定温度下,向饱和的NaOH溶液中加入少量的Na2O2固体,充分反应后恢复到原来的室温,下列叙述不合理的是?????????????????????????????????????????????(???)
A.NaOH溶液浓度增大,并且放出O2
B.溶液的质量变小,有O2放出
C.NaOH的质量分数不变,有NaOH晶体析出
D.溶液中Na+的物质的量浓度不变,但物质的量减少了
|
|