微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某学生实验小组用50 mL 0.50 mol·L-1的盐酸与50 mL 0.50 mol·L-1的NaOH溶液在右图所示的装置中进行中和反应反应热的测定。
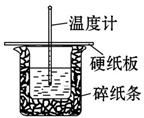
(1)图中装置缺少一种仪器,该仪器名称为______。
(2)下列说法正确的是______。
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯
D.可用相同浓度和体积的硝酸代替稀盐酸溶液进行实验
参考答案:环形玻璃搅拌棒???? AD
本题解析:
试题分析:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,故答案为:环形玻璃搅拌器;
(2)A、小烧杯内残留有水,会导致混合液的体积变大,混合液温度降低,温度差减小,测得的反应热数值偏小,故A正确;B、在中和热的测定过程中,酸碱混合时要迅速,并且不能搅拌,防止热量的散失,保证放出的热量都体现在温度计温度的升高上,故B错误;C、烧杯间填满碎纸条的作用是保温,减少热量的散失,故C错误;D、中和热的含义是稀的强酸和强碱溶液反应生成1mol水的过程中所放出的热量,可用相同浓度和体积的硝酸
本题难度:一般
2、选择题 下列关于热化学反应的描述中正确的是
A.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
B.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57. 3)kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
参考答案:A
本题解析:
试题分析:A、燃烧热是指1摩尔可燃物完全燃烧生成稳定的氧化物,所以当方程式系数为2时,表示是2摩尔一氧化碳反应,反应热为2×283.0kJ/mol,选A;B、硫酸和氢氧化钙生成硫酸钙沉淀,生成1摩尔水时反应热不是-57.3kJ/mol,不选B;C、需要加热的反应不一定是吸热反应,不选C;D、1摩尔甲烷完全燃烧生成稳定的氧化物时的反应热为燃烧热,即生成液态水,不是生成气态水,不选D。
考点:燃烧热,热化学方程式的意义。
本题难度:一般
3、选择题 1 g氢气燃烧生成液态水时放出142.9 kJ热量,表示该反应的热化学方程式正确的是?????????????????
A.2H2(g)+O2(g) 2H2O(l) ΔH="-142.9" kJ·mol-1?
2H2O(l) ΔH="-142.9" kJ·mol-1?
B.2H2(g)+O2(g)  2H2O(l) ΔH="-571.6" kJ·mol-1?
2H2O(l) ΔH="-571.6" kJ·mol-1?
C.2H2+O2 2H2O ΔH="-571.6" kJ·mol-1?
2H2O ΔH="-571.6" kJ·mol-1?
D.2H2(g)+O2(g)  2H2O(l) ΔH="+571.6" kJ·mol-1?
2H2O(l) ΔH="+571.6" kJ·mol-1?
参考答案:B
本题解析:1 g氢气的物质的量为0.5mol,燃烧放出142.9 kJ热量;在热化学方程式中,化学计量表示参加反应的物质的物质的量且书写时要注明反应物和生成的状态,同时放热反应用“—”表示;所以
A错,该方程式中氢气的物质的量为2mol,放出的热量会成倍数变化;
B正确,
C错,未注明反应物和生成物的状态;
D错,放热反应用“—”表示
本题难度:简单
4、填空题 (2分)在PH=1的硫酸溶液中,由水电离出的H+的物质的量浓度是??????????。
参考答案:1×10-13 mol·L-1
本题解析:略
本题难度:简单
5、选择题 下列叙述正确的是
A.可以根据PbI2和AgCl的Ksp的大小比较两者的溶解度
B.常温下,同浓度的Na2S与NaHS溶液相比,NaHS溶液的pH大
C.等物质的量浓度的CH3COONH4溶液和NH4HSO4溶液,前者的c(NH4+)大
D.用惰性电极电解饱和NaCl溶液,若有1.0 mol电子转移,则理论生成1.0 mol NaOH
参考答案:D
本题解析:PbI2和AgCl的原子组成个数不同,因此不能直接利用Ksp的大小来比较两者的溶解度。S2-的水解程度大于SH-的水解程度,所以Na2S溶液的pH大。CH3COONH4溶液中CH3COO-和NH4+的水解相互促进,而在NH4HSO4溶液中氢离子的大量存在会抑制NH4+的水解,所以NH4HSO4溶液中的c(NH4+)大。根据电荷守恒可知,D正确。答案是D。
本题难度:简单