3.5
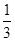 Fe2O3(s)+CO(g) Fe2O3(s)+CO(g)   Fe(s)+CO2(g).该反应在不同 Fe(s)+CO2(g).该反应在不同
温度下的平衡常数如下:请回答下列问题:
(1)该反应的平衡常数表达式K= ,
ΔH 0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)= ,CO的平衡转化率= ;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是( )
A减少Fe的量 B增加Fe2O3的量 C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
参考答案:(1) 本题解析: 本题解析:
试题解析:(1)反应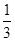 Fe2O3(s)+CO(g)? Fe2O3(s)+CO(g)? Fe(s)+CO2(g)的平衡常数k= Fe(s)+CO2(g)的平衡常数k=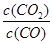 ,由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应,即△H<0;<;(2)令平衡时CO的物质的量变化为nmol,则: ,由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应,即△H<0;<;(2)令平衡时CO的物质的量变化为nmol,则:
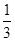 Fe2O3(s)+CO(g)? Fe2O3(s)+CO(g)? Fe(s)+CO2(g) Fe(s)+CO2(g)
开始(mol): 1 1
变化(mol): n n
平衡(mol): 1-n n+1
所以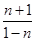 =4,解得n=0.6,所以n(CO)= =4,解得n=0.6,所以n(CO)=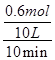 ="0.006" mol?L-1?min-1,CO的平衡转化率为 ="0.006" mol?L-1?min-1,CO的平衡转化率为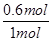 ×100%=60%;(3)铁是固体,减少Fe的量,不影响平衡移动,CO的平衡转化率不变,故A错误;氧化铁是固体,增加Fe2O3的量,不影响平衡移动,CO的平衡转化率不变,故B错误;移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故C正确;该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故D错误;反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故E错误;加入合适的催化剂,平衡不移动,故F错误。 ×100%=60%;(3)铁是固体,减少Fe的量,不影响平衡移动,CO的平衡转化率不变,故A错误;氧化铁是固体,增加Fe2O3的量,不影响平衡移动,CO的平衡转化率不变,故B错误;移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故C正确;该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故D错误;反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故E错误;加入合适的催化剂,平衡不移动,故F错误。
考点:化学平衡的计算
本题难度:一般
2、填空题 (16分)
运用化学反应原理研究氮、氧等元素的单质及其化合物的反应有重要意义。
 Ⅰ.(1)一定温度和压强下,反应N2(g) + 3H2(g) Ⅰ.(1)一定温度和压强下,反应N2(g) + 3H2(g)  2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡 (填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH (填“增大”、“减小”或“不改变”)。 2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡 (填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH (填“增大”、“减小”或“不改变”)。
 (2)在一定温度和压强下,已知: (2)在一定温度和压强下,已知:
O2 (g) = O2+ (g) + e-;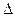 H1=" 1175.7" kJ/mol H1=" 1175.7" kJ/mol
 PtF6 (g) + e- = PtF6- (g); PtF6 (g) + e- = PtF6- (g);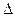 H2=" H2="
参考答案:
本题解析:
本题难度:一般
3、选择题 COCl2(g)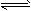 CO(g)+Cl2(g) ΔH>0当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是 [???? ] CO(g)+Cl2(g) ΔH>0当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是 [???? ]
A.①②④
B.①④⑥
C.②③⑥
D.③⑤⑥
参考答案:B
本题解析:
本题难度:一般
4、选择题 已知Cl2和H2O(g)在一定条件下达到下列平衡:2Cl2 (g)+2H2O(g)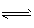 4HCl(g)+O2 (g) △H>0。下列条件X改变时,Y的变化符合下图曲线的变化的是?? 4HCl(g)+O2 (g) △H>0。下列条件X改变时,Y的变化符合下图曲线的变化的是??
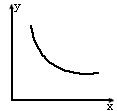
[???? ]
?????????????? X???????????????????????? Y
A ?恒容下,加入O2?????? HCl的浓度
B? 升高温度????????????????? 平衡常数K
C? 增大容器体积?????????? HCl的物质的量
D? 加入催化剂????????????? O2的物质的量
参考答案:A
本题解析:
本题难度:一般
5、填空题 过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式:
(2)Na2O2、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是____________(写电子式),
臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:
KI+O3+H2O→KOH+I2+O2(未配平 ) 回答问题:
① 还原产物的化学式为
② 配平后的化学方程式是
(4)O3 可由臭氧发生器(原理如下图所示)电解稀硫酸制得。
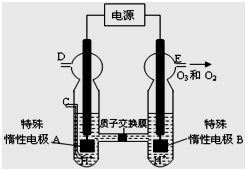
①图中阴极为 (填“A”或“B”)。
② 若C处不通入O 2 ,D、E处分别收集到11.2L和有4.48L
气体(标准状况下), 则E处收集的气体中O3所占的体积分数
为 (忽略 O 3 的分解)。
③ 若C处通入O 2,则A极的电极反应式为: 。
(5)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+ O3(g) NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是 NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
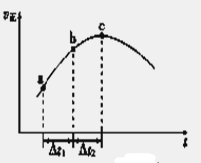
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.反应物的总能量低于生成物的总能量
d.Δt1=Δt2时,NO的转化率:a~b段小于b~c段
参考答案:(1)H2O2+2H++2Fe2+=2Fe3++2H2O <
本题解析:
试题分析:(1)过氧化氢与氯化亚铁发生氧化还原反应生成氯化铁和水,离子方程式为H2O2+2H++2Fe2+=2Fe3++2H2O ;
(2)过氧化物与稀硫酸反应制取过氧化氢最合适的过氧化物是过氧化钡,因为过氧化钡与稀硫酸反应生成过氧化氢和硫酸钡沉淀,过滤即可除去硫酸钡,过氧化钡的电子式为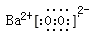 ; ;
(3)①该反应中的臭氧是氧化剂,KI是还原剂,所以还原产物是臭氧对应的产物,O元素的化合价降低,则还原产物的化学式为KOH;
②臭氧中O元素的化合价是0价,KOH中O元素中化合价是-2价,化合价降低2价,KI中I的化合价是-1价,碘中I的化合价是0价,化合价升高1价,则KI的系数是2,臭氧的系数是1,碘的系数是1,根据H元素守恒,则水的系数是1,所以氧气的系数是1,则化学方程式为O3+2KI+H2O=2KOH+I2+O2
(4)①电解硫酸溶液制取臭氧,B极产生氧气和臭氧,说明O元素的化合价升高,发生氧化反应,所以B端是阳极,接电源的正极,则A接电源的负极,作电解池的阴极;
②若C处不通入O2,D处收集到的气体是氢气,E处收集到的气体是臭氧和氧气,11.2L的氢气的物质的量是0.5mol, 4.48L的氧气和臭氧的物质的量是0.02mol,生成0.5mol氢气转移电子的物质的量是1mol,设臭氧的物质的量为xmol,则氧气的物质的量是0.02mol-xmol,根据得失电子守恒,1mol=6xmol+4(0.02mol-xmol),解得x=0.01mol,所以E处收集的气体中O3所占的体积分数也即物质的量分数0.01/0.02=50%;
③若C处通入O 2,则A极是氧气发生还原反应,电极反应式为O2+4H++4e-=2H2O;
(5)该反应反应前后气体的物质的量不变,容器体积不变,故体系压强恒定.绝热恒容密闭容器,体系温度随反应进行变化,随反应进行反应物的浓度降低,由图可知,c点以前正反应速率增大,说明体系温度升高,正反应为放热反应,c点以后反应正反应速率降低,应是浓度影响比温度影响更大.图为正反应速率随时间变化,说明反应未到达平衡。
a.反应在c点前,温度对速率影响大,c点以后浓度减小对速率影响大,所以C点未达到平衡状态,错误;b.反应未达平衡,b点在c点之前,所以反应物浓度:b点大于c点,错误;c.该反应为放热反应,反应物的总能量高于生成物的总能量,错误;d.a~b段反应速率小于b~c段反应速率,根据v=△c/△t,得△t1=△t2时,b~c段消耗NO更多,故NO的转化率:a~b段小于b~c段,正确,答案选d。
考点:考查电解池反应原理、氧化还原反应计算、化学平衡图象的分析、化学方程式的配平,电子式的书写
本题难度:困难
|