Ki1= 9.1×10-8, Ki2= 1.1×10-12
A.0.10mol/L的下列各溶液pH:Na2S<Na2CO3
B.HCO3-+CH3COOH→H2O+CO2↑+CH3COO-
C.硫化钠溶液可以与碳酸氢钠溶液反应
D.pH相同的CH3COOH、H2CO3、H2S,溶液浓度依次减小
参考答案:BC
本题解析:
试题分析:A.电离常数越大酸性越强,则根据电离平衡常数可知酸性是碳酸氢钠大于硫氢化钠,酸性越弱,酸根越容易水解,溶液的碱性越强,则0.10mol/L的下列各溶液pH:Na2S>Na2CO3,A错误;B.醋酸的酸性强于碳酸,则根据较强酸制备较弱酸可知HCO3-+CH3COOH→H2O+CO2↑+CH3COO-,B正确;C.酸性是碳酸氢钠大于硫氢化钠,则硫化钠溶液可以与碳酸氢钠溶液反应生成硫氢化钠和碳酸钠,C正确;D.酸性是CH3COOH>H2CO3>H2S,则pH相同的CH3COOH、H2CO3、H2S,溶液浓度依次增大,D错误,答案选BC。
考点:考查电离平衡常数的应用
本题难度:一般
2、选择题 在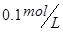 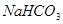 溶液中,下列关系中不正确的是 溶液中,下列关系中不正确的是
A.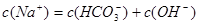
B.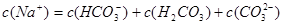
C. -c(CO32-) -c(CO32-)
D.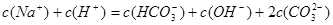
参考答案:A
本题解析:略
本题难度:一般
3、选择题 下列溶液中微粒的物质的量浓度关系正确的是
A.常温下电离常数为Ka的酸HA 溶液中 c (H+)=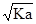 mol·L-1 mol·L-1
B.0.2mol·L-1 CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
C.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4)
D.常温下,向0.1mol/L NH4HSO4溶液中滴加NaOH溶液至中性c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
参考答案:B
本题解析:
试题分析:A、Ka=c(H+)×c(A-)/c(HA),HA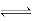 H++A-,c(H+)= H++A-,c(H+)= 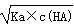 ,错误;B、反应后溶液中溶质:CH3COOH、CH3COONa,且两种物质的物质的量是相同,根据物料守恒得出:c(CH3COOH)+c(CH3COO-)=2c(Na+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),两者合并得到:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),正确;C、有白色沉淀产生,只能说明此时溶液中的c(Ca2+)×c(SO42-)>Ksp(CaSO4),不能说明Ksp[Ca(OH)2]大于Ksp(CaSO4),错误;D、NH4HSO4和NaOH按1:1反应生成(NH4)2SO4、Na2SO4,溶液显酸性,按1:2反应Na2SO4、NH4·H2O,溶液显碱性,因此溶液显中性,若NH4HSO4是1mol,则NaOH的量应在1~2之间,NH4+水解,c(SO42-)>c(NH4+),因此浓度大小:c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-),错误。 ,错误;B、反应后溶液中溶质:CH3COOH、CH3COONa,且两种物质的物质的量是相同,根据物料守恒得出:c(CH3COOH)+c(CH3COO-)=2c(Na+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),两者合并得到:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),正确;C、有白色沉淀产生,只能说明此时溶液中的c(Ca2+)×c(SO42-)>Ksp(CaSO4),不能说明Ksp[Ca(OH)2]大于Ksp(CaSO4),错误;D、NH4HSO4和NaOH按1:1反应生成(NH4)2SO4、Na2SO4,溶液显酸性,按1:2反应Na2SO4、NH4·H2O,溶液显碱性,因此溶液显中性,若NH4HSO4是1mol,则NaOH的量应在1~2之间,NH4+水解,c(SO42-)>c(NH4+),因此浓度大小:c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-),错误。
考点:考查弱电解质的电离、离子浓度大小的比较、溶度积的计算等知识。
本题难度:困难
4、选择题 氯化铵晶体溶于重水(D2O)中,溶液呈现酸性,下列叙述的原因中正确的是
A.NH4+水解生成NH3·H2O和HD2O+
B.NH4+水解生成NH3·DHO和HD2O+
C.NH4+水解生成NH3·D2O和HD2O+
D.NH4+水解生成NH3·DHO和D3O+
参考答案:D
本题解析:氯化铵是强酸弱碱盐,NH4+水解显酸性。水解的实质是NH4+结合水电离出的OH-生成一水合氨,在重水中则结合OD-生成NH3·DHO。在重水中氢离子是以D3O+形式存在。所以正确的答案是D。
本题难度:困难
5、选择题 下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
①在0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
②在0.1 mol·L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
③向0.2mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
④常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
A.①④
B.②④
C.①③
D.②③
参考答案:B
本题解析:
试题分析:①HCO3-以水解为主,c(H2CO3) > c(CO32-);②是质子守恒;③混合溶液中,同浓度CO32-水解程度大于HCO3-,且生成HCO3-,c(HCO3-) > c(CO32-) ;④CH3COONa和CH3COOH混合溶液中,电荷守恒,c(CH3COO-) =c(Na+)=0.1 mol·L-1 >c(H+)=c(OH-),因此选B。
考点:主要考查盐类水解产物。
本题难度:困难
|