氧化性:Cl2>Br2>I2
参考答案:C
本题解析:
试题分析:A、大理石与盐酸反应制取的二氧化碳气体中可能含有HCl,则HCl与硅酸钠溶液反应产生硅酸沉淀,所以未除去二氧化碳中的HCl,直接将二氧化碳通入硅酸钠溶液中,则不能说明碳酸的酸性比硅酸强,错误;B、向某溶液中加入硝酸酸化的氯化钡溶液,产生不溶于硝酸的白色沉淀,则溶液中可能含有银离子、SO42-、SO32-、HSO3-中的一种或几种,错误;C、饱和氯化铁溶液的浓度比0.005mol/L大,所以加入饱和氯化铁溶液后,溶液的红色加深,可以证明增大反应物浓度,平衡向正反应方向移动,正确;D、通入的氯气可以与NaBr、KI都反应,生成溴单质、碘单质,所以右边棉球变为蓝色,不能说明是溴与KI发生的置换反应,则不能证明氧化性:Cl2>Br2>I2,错误,答案选C。
考点:考查对实验方案的分析与评价
本题难度:困难
2、选择题 下列溶液中有关物质的量浓度关系不正确的是
A.10℃时pH=12的NaOH溶液与40℃时pH=12的NaOH溶液中:c(H+)相等
B.25℃时pH=10的NaOH溶液与pH=10的氨水中: c(Na+)=c(NH4+)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1mol·L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+ c(NH3·H2O) + c(Fe2+)="0.3" mol·L-1
参考答案:D
本题解析:A.由pH=—lgc(H+)可知,pH相等,则c(H+)相等,正确
B.两溶液中分别存在电荷守恒:c(H+)+ c(Na+)=c(OH-)、c(H+)+ c(NH4+)=c(OH-),由于pH相同,则两溶液中的c(H+)、c(OH-)均对应相等,则必定 c(Na+)=c(NH4+),正确
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
其中电荷守恒为: c(CH3COO-)+c(OH-)=c(H+)+c(Na+)
物料守恒为: c(CH3COO-)+c(CH3COOH)=2c(Na+)
合并两式可得: c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),正确
D.由物料守恒可知c(NH4+)+ c(NH3·H2O) ="0.2" mol·L-1,而由于Fe2+部分水解,其浓度必定小于0.1 mol·L-1,故不正确
答案为D
本题难度:一般
3、填空题 (10分)已知H2SO3是二元弱酸,常温下现有0.1 mol/L H2SO3溶液,请回答以下问题:
(1)若向H2SO3溶液中加入少量NaHSO3固体,此时溶液中c(H+)/ c(HSO3-)________(填“增大”“减小”或“不变”)。
(2)若向H2SO3溶液中加入等浓度的NaOH溶液,且二者的体积比为2∶3,若反应后溶液可使紫色石蕊变红色,则所得溶液中物料守恒式为0.1 mol/L=______________,所得溶液中各离子的物质的量浓度由大到小的顺序是__________________。
(3)若向H2SO3溶液中加入NaOH溶液至溶液恰好呈中性,此时c(Na+)______2c(SO32-)(选填“>”、“<”或“=”)。
(4)若向H2SO3溶液中加入一定量NaOH溶液,所得混合液pH=6,则此溶液中
2c(SO32-) +c(HSO3-)-c(Na+)=________mol/L。
参考答案:(1)减小 (2)c(Na+)+c(SO32-)+c(HSO
本题解析:
试题分析:(1)H2SO3溶液存在电离平衡,H2SO3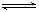 H++ HSO3-,加入NaHSO3固体使得c(HSO3-)增大,所以c(H+)/ c(HSO3-)减小。(2)加入NaOH溶液,体积比为2∶3,H2SO3溶液过量,溶液的主要溶质为NaHSO3,Na2SO3,物料守恒为:c(Na+)+c(SO32-)+c(HSO3-)+c(H2SO3) =0.1 mol/L,HSO3的电离程度大于水解程度,故溶液显酸性,浓度关系为c(Na+)>c(SO32-)>c(HSO3-)>c(H+)>c(OH-)。(3)根据电荷守恒 c(Na+)+ c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),溶液显中性则c(H+)= c(OH-),所以c(Na+)+ =2c(SO32-)+c(HSO3-),故c(Na+) >2c(SO32-)。( 4 )根据电荷守恒c(Na+)+ c(H+)=2c(SO32-)+c(HSO3-)+c(OH-), pH=6,所以c(H+)=10-6 mol/L, c(OH-)=10-8 mol/L得2c(SO32-) +c(HSO3-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8 H++ HSO3-,加入NaHSO3固体使得c(HSO3-)增大,所以c(H+)/ c(HSO3-)减小。(2)加入NaOH溶液,体积比为2∶3,H2SO3溶液过量,溶液的主要溶质为NaHSO3,Na2SO3,物料守恒为:c(Na+)+c(SO32-)+c(HSO3-)+c(H2SO3) =0.1 mol/L,HSO3的电离程度大于水解程度,故溶液显酸性,浓度关系为c(Na+)>c(SO32-)>c(HSO3-)>c(H+)>c(OH-)。(3)根据电荷守恒 c(Na+)+ c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),溶液显中性则c(H+)= c(OH-),所以c(Na+)+ =2c(SO32-)+c(HSO3-),故c(Na+) >2c(SO32-)。( 4 )根据电荷守恒c(Na+)+ c(H+)=2c(SO32-)+c(HSO3-)+c(OH-), pH=6,所以c(H+)=10-6 mol/L, c(OH-)=10-8 mol/L得2c(SO32-) +c(HSO3-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8
考点:水解平衡的离子浓度小大小比较。
本题难度:困难
4、选择题 下列溶液中有关物质的量浓度关系不正确的
A.pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A)
参考答案:B
本题解析:
试题分析:A项是电荷守恒,正确;NaOH是强碱,完全电离,CH3COONa和Na2CO3溶液是因为水解溶液显碱性,CO32-的水解程度比CH3COO-大,要pH相同,CH3COONa更大才行,B不正确;由电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+)和物料守恒c(CH3COO-)+c(CH3COOH)=2c(HNa+)可得c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),C正确;NaHA溶液的pH=4说明HA-的电离程度比水解程度大,D正确。
考点:溶液中的守恒规律的应用、电离和水解程度对溶液的酸碱性的影响。
本题难度:困难
5、选择题 下列物质中,能发生水解反应的是( )
A.苯
B.乙酸
C.淀粉
D.葡萄糖
参考答案:C
本题解析:
本题难度:一般
|