微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 控制适合的条件,将反应Fe2++Ag+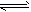 Ag + Fe3+设计成如下图所示的原电池。下列判断错误的是
Ag + Fe3+设计成如下图所示的原电池。下列判断错误的是
 [???? ]
[???? ]
A.反应开始时,电子从甲中石墨经导线流向乙中石墨
B.电流计指针为零时,上述反应的正反应速率等于逆反应速率
C.电流计读数为零后,在甲中加入FeCl3固体,乙中石墨电极反应为Ag - e- == Ag+
D.电流计读数为零后,在乙中加入硫化钠固体,电流计指针读数仍为零
参考答案:D
本题解析:
本题难度:一般
2、选择题 镁燃料电池作为一种高能化学电源,具有良好的应用前景。如图是镁-空气燃料电池工作原理示意图。下列有关该电池的说法正确的是? ( )。

A.该电池Mg作负极,发生还原反应
B.该电池的正极反应式为O2+2H2O+4e-=4OH-
C.电池工作时,电子通过导线由碳电极流向Mg电极
D.当电路中通过0.2 mol电子时,消耗的O2体积为1.12 L
参考答案:B
本题解析:镁作负极,失电子,发生氧化反应,A错;电池工作时,电子由负极经导线流向正极,即由镁电极流向碳电极,C错;由于没有说明O2所处的状态,所以无法计算O2的体积,D错。
本题难度:一般
3、计算题 (6分)由等质量的锌片、铜片组成的Zn—Cu—H2SO4原电池,工作一段时间后,锌片的质量减少了2.6g。求:
(1)生成氢气的体积(标准状况);
(2)若将电解质溶液改为硫酸铜溶液,当电池两极的质量差为12.9 g时,从电池中流出的电子数目。
参考答案:(1)896mL(3分)??????????????????
本题解析:略
本题难度:简单
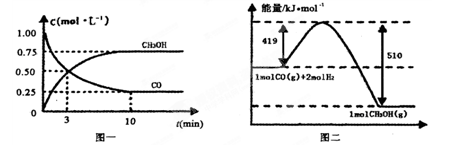
4、填空题 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知反应  Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
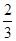 Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1. 0mol,反应经过l0min后达到平衡。
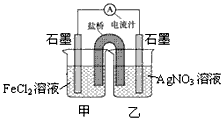
(1)CO的平衡转化率=____________
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g) CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡
参考答案:
本题解析:
本题难度:困难
5、填空题 某原电池装置中盛有浓KOH溶液,若分别向__________(填“正”或“负”,下同)极通入可燃性气体,向__________极通入O2,则电路中就有电流通过,电流方向由__________极流向__________极,溶液中OH-向__________极移动。试完成下列问题:
| 可燃性气体
| 正极反应
| 负极反应
| 电池总反应
| pH变化
|
(1)
| H2
|
|
|
|
|
(2)
| CO
|
|
|
|
(3)
| CH4
|
|
|
参考答案:负 正 正 负 负
正极反应
本题解析:本题设计的是燃料电池,可燃性气体在负极发生氧化反应,O2在正极发生还原反应,电子从负极流出,通过导线流向正极,电子流动方向和电流方向正好相反,在电池内部(电解质溶液中)阴离子(OH-)向负极移动。由于题中给出的燃料电池是碱性介质,因此在书写电极反应式时要注意到H2的氧化产物H+以及CO和CH4的氧化产物CO2与OH-继续反应。
本题难度:一般
|