微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 两种有机物以一定比例混合,一定条件下在aLO2(足量)中充分燃烧恢复到原状态,再通过足量的过氧化钠,得到气体仍是 aL,下列组合中符合此条件的是:
A.CH4、C2H4
B.CH3CH2OH 、CH3COOH
C.C2H6、HCHO
D.HCHO、HCOOCH3
参考答案:D
本题解析:气体体积不变,所以相当于氧气没有参与反应,因此根据Na2O2→2NaOH、Na2O2→Na2CO3可知,有机物的组成应该是(CO)n(H2)m,所以选项D正确,答案选D。
本题难度:简单
2、选择题 25 ℃、101 kPa下:①2Na(s)+O2(g)=Na2O(s)?;? ΔH1=-414 kJ/mol
②2Na(s)+O2(g)=Na2O2(s)?;? ΔH2=-511 kJ/mol?
下列说法正确的是
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25 ℃、101 kPa下,Na2O2(s)+2Na(s)=2Na2O(s) ; ΔH=-317 kJ/mol
参考答案:D
本题解析:
试题分析:A、Na2O 和Na2O2中阴阳离子个数比都为1:2,Na2O2中阴离子是O22-,错误;B、根据氧化还原反应原理最终都是Na从0价升高到+1价,每生成1摩尔Na2O 或Na2O2,都转移2摩尔电子,错误;C、钠和氧气在加热时反应生成Na2O2,错误;D、根据盖斯原理方程式①×2-②,-414×2+511=-317,正确。
本题难度:一般
3、选择题 取16.8g碳酸氢钠固体,加热一段时间后,剩余固体的质量为13.7g。把剩余固体加入到100mL 2mol/L的稀硫酸中,充分反应后溶液中H+的浓度约为
A.3 mol/L
B.2 mol/L
C.1.4 mol/L
D.1 mol/L
参考答案:B
本题解析:
试题分析:根据反应结果分析,无论碳酸氢钠还是分解后的碳酸钠,钠原子量不变,根据产物硫酸钠得出反应的硫酸的量为钠原子量的一半(Na2SO4),故剩余硫酸的量为:0.1×2-16.8÷84÷2=0.1mol,反应后H+的浓度约为0.1mol×2÷0.1L="2" mol/L。
本题难度:一般
4、选择题 下列关于碱金属元素的叙述正确的是(???)
A.它们都能在空气中燃烧生成M2O
B.它们失去电子的能力很强,故在自然界中无游离态存在
C.它们的焰色反应都是黄色
D.它们都能与水反应生成碱和氢气
参考答案:BD
本题解析:碱金属元素在空气中燃烧,Na生成了Na2O,则K、Rb、Cs都生成了比较复杂的化合物,故选项A是错的,选项B是正确的。只有Na的焰色反应才是黄色的,而其他碱金属元素的焰色反应却不是这样的,故C项是错误的。碱金属元素与水反应是剧烈的,都能生成碱和氢气,所以D项是正确的。
本题难度:简单
5、选择题 钠在干燥空气中形成的氧化物0.70g,溶于水后,可被100g质量分数为0.73%的盐酸恰好中和,钠的氧化物的成分是(???)
A.Na2O2和Na2O
B.Na2O
C.Na2O2
D.无法确定
参考答案:A
本题解析:
试题分析:由于不知道产物是 Na2O还是Na2O2,或者二者都有,因此设定一个化学式Na2OX,算出摩尔质量,与两种氧化物的对比即可判断。
n(盐酸)=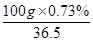 =0.02mol
=0.02mol
溶液恰好能被100g?质量分数为0.73%的盐酸溶液中和
则?? Na2OX?~2NaOH~2HCl
0.0
本题难度:一般