微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式正确的是
A.硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+===BaSO4↓
B.将大理石投入到足量盐酸中:CO32-+2H+===CO2↑+H2O
C.将Cl2通入KI溶液中:2I-+Cl2===2Cl-+I2
D.硫酸镁溶液和氢氧化钡溶液反应:SO42-+Ba2+===BaSO4↓
参考答案:C
本题解析:
试题分析:A.硫酸铜溶液与氢氧化钡溶液反应生成两种沉淀,硫酸钡和氢氧化铜,错误;B.大理石难溶于水,写化学式,错误;C.将Cl2通入KI溶液中:2I-+Cl2===2Cl-+I2[,正确;D.硫酸镁溶液和氢氧化钡溶液反应生成两种沉淀,硫酸钡和氢氧化镁,错误;选C。
考点:考查离子方程式的正误判断。
本题难度:一般
2、填空题 现有下列物质:①Na2CO3 ②铜 ③氯化氢 ④CO2 ⑤NaHSO4 ⑥Ba(OH)2 ⑦氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩KI
(1)按物质的分类方法填写表格的空白处(填物质编号)
分类标准
| 电解质
| 盐
| 非电解质
| 混合物
|
属于该类
的物质
|
|
|
|
(2)上述某两种物质在溶液中可发生离子反应:H++OH-= H2O,写出其中一个该离子反应对应的化学方程式 。
(3)物质⑩的稀溶液在空气中被氧化,加入淀粉溶液显蓝色,则反应的离子方程式为: 。
参考答案:
(1)①③⑤⑥⑩
本题解析:
试题分析:(2)符合离子反应H++OH-= H2O应为强酸和强碱反应,且不能生成沉淀、气体等产物,所以应用氯化氢、稀硝酸于Ba(OH)2反应;(3)碘离子具有较强的还原性,根据题意其被氧化为碘单质,溶液为中性环境,方程式为O2 + 4I- + 2 H2O = 2I2 + 4OH-。
考点:考查物质分类和离子方程式书写等有关问题。
本题难度:一般
3、选择题 下列离子方程式书写正确的是
①将金属Na投入水中:2Na+2H2O=2Na++2OH-+H2↑
②在硫酸溶液中加入氢氧化钡溶液至中性:Ba2++OH-+H++SO2-4=BaSO4↓+H2O
③碳酸氢钙溶液中滴加盐酸:HCO3-+H+=CO2↑+H2O
④碳酸钙中滴加盐酸:CO32--+2H+=CO2↑+H2O
A.①③④
B.①③
C.②④
D.①②③
参考答案:B
本题解析:
试题分析:①将金属Na投入水中:2Na+2H2O=2Na++2OH-+H2↑,①正确;②在硫酸溶液中加入氢氧化钡溶液至中性:Ba2++2OH-+2H++SO2-4=BaSO4↓+2H2O,②错误;③来源:91考试网 91Exam.org碳酸氢钙溶液中滴加盐酸:HCO3-+H+=CO2↑+H2O,③正确;④碳酸钙中滴加盐酸:CaCO3+2H+=Ca2++CO2↑+H2O,④错误;答案选B。
考点:考查离子方程式正误判断。
本题难度:一般
4、选择题 下列反应的离子方程式正确的是
A.用惰性电极电解MgCl2溶液: 2Cl? + 2H2O ="=" Cl2↑+H2↑+2OH?
B.硫化钠发生水解: S2?+H2O = HS?+OH?
C.少量小苏打溶液滴入Ba(OH)2溶液中:HCO?3 + Ba2+ + OH?- = BaCO3↓+H2O
D.向NH4HSO4溶液中加入NaOH溶液至混合液为中性:H++OH?= H2O
参考答案:C
本题解析:A错,正确离子方程式为:Mg2++2Cl? + 2H2O ="=" Cl2↑+H2↑+Mg(OH)2↓;B错,正确离子方程式为:S2?+H2O ?HS?+OH?;C正确;D错,该离子方程式表示溶液中氢离子与氢氧根离子恰好完全反应,溶液显酸性;
本题难度:一般
5、填空题 (10分)霞石是一种硅酸盐,其组成可表示为K2O·3Na2O·4Al2O3·8SiO2,某小组同学设计以霞石为原料制备Al2O3的方案如下:
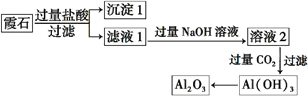
请回答下列问题:
(1)沉淀1的主要成分的化学式为 。
(2)向滤液1中加入过量NaOH溶液的有关反应离子方程式为 。
(3)由溶液2生成Al(OH)3的离子方程式为 。
(4)某同学提出上述流程较繁琐,可简化流程,其方法是向滤液1中加入足量的试剂X即可得到Al(OH)3,则试剂X为 。
参考答案:(1) SiO2 (2分)
(2
本题解析:
试题分析:霞石(K2O·3Na2O·4Al2O3·8SiO2)加入过量盐酸后SiO2不溶转化为沉淀1,其他成分转化为KCl、NaCl、AlCl3、以及过量的盐酸存在滤液1中,滤液1加入过量NaOH溶液后溶液2的成分为KCl、NaCl、NaAlO2、以及过量的NaOH,再通入过量CO2时,生成Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3。(1) 沉淀1的主要成分的化学式为SiO2;(2) 向滤液1中能与过量NaOH反应的物质有AlCl3和盐酸,有关反应离子方程式为:H++OH- = H2O 、Al3++4OH- = AlO2-+2H2O(或Al3++3OH- = Al(OH)3↓ ,Al(OH)3+OH- = AlO2-+2H2O);(3) 过量CO2与溶液2中的NaAlO2反应生成Al(OH)3的离子方程式为:AlO2-+CO2+2H2O = Al(OH)3↓+HCO3-;(4) Al(OH)3可溶于强碱但不溶于弱碱氨水,向滤液1中加入过量的NaOH溶液产生NaAlO2再通入过量CO2产生Al(OH)3,流程繁琐且试剂用量多,若用氨水代替,过量的氨水直接将滤液1中的AlCl3转化为Al(OH)3,故X为氨水。
考点:考查铝的化合物的性质。
本题难度:一般
|