微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列解释事实的离子方程式不正确的是
A.84消毒液和洁厕灵混合使用会产生有毒气体:Cl-+ClO-+2H+=Cl2↑+H2O
B.向水玻璃中加入盐酸有白色沉淀生成:2H++SiO32-=H2SiO3↓
C.SO2使紫色石蕊溶液变红色:SO2+H2O 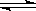 2H++SO32-
2H++SO32-
D.漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3C1O-+3H2O=Fe(OH)3↓+3HClO
参考答案:C
本题解析:
试题分析:A.消毒液的次氯酸钠与洁厕灵主要成份盐酸混合发生归中反应产生氯气,方程式为:Cl-+ClO-+2H+=Cl2↑+H2O,A正确;B.向水玻璃即硅酸钠溶液中加入盐酸有白色沉淀生成:2H++SiO32-=H2SiO3↓,B正确;C.SO2使紫色石蕊溶液变红色是由于SO2溶于水生成弱酸亚硫酸:SO2+H2O H2SO3,C错误;D.漂白粉溶液中次氯酸水解溶液显碱性,加氯化铁溶液产生大量红褐色沉淀:Fe3++3C1O-+3H2O=Fe(OH)3↓+3HClO,D正确,答案选C。
H2SO3,C错误;D.漂白粉溶液中次氯酸水解溶液显碱性,加氯化铁溶液产生大量红褐色沉淀:Fe3++3C1O-+3H2O=Fe(OH)3↓+3HClO,D正确,答案选C。
考点:考查离子方程式的正误判断
本题难度:一般
2、选择题 下列离子方程式正确的是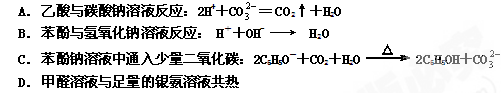
参考答案:D
本题解析:略
本题难度:一般
3、填空题 现有含NH4+、H+、Al3+、Mg2+、Cl-的溶液100mL,往其中逐滴加入2mol/L的氢氧化钠溶液,并不断搅拌,所得沉淀质量与所加氢氧化钠溶液体积的关系如下图,其中OA段无气体产生,回答下列问题。

(1)写出下列过程发生反应的离子方程式。
OA段: ;
CD段: ;
(2)氢氧化镁沉淀的质量m[Mg(OH)2] = g。
(3)a = ;b = 。
(4)原溶液中c(NH4+) = ;c(Cl-) = 。
参考答案:(16分)
(1)H+ + OH- = H2O(3分
本题解析:
试题分析:(1)OA段无气体产生,说明是H+和OH-的反应,离子方程式为H+ + OH- = H2O。
CD段是沉淀溶解的过程,Al(OH)3是和OH-反应,离子方程式为Al(OH)3 + OH- = [Al(OH)4]-。
(2)最终沉淀的物质是氢氧化镁沉淀,根据图中信息可得其质量等于0.58g。
(3)V(NaOH)=25mL,n(NaOH)=0.05mol,AB段,生成的沉淀是Al(OH)3和Mg(OH)2,m[Mg(OH)2] =0.58g,Mg(OH)2中的n(OH-)=0.02mol,则Al(OH)3中的n(OH-)=0.05mol-0.02mol=0.03mol,即m[Al(OH)3]=0.78g,故总质量=0.58g+0.78g=1.36g,即a=1.36g。Al(OH)3 + OH- = [Al(OH)4]-,n[Al(OH)3]=0.01mol,消耗NaOH为0.01mol,体积为0.005L,即5ml,故b=50+5=55。
(4)BC段NH4+和OH-的反应,反应的n(OH-)=0.02mol,NH4++OH-=NH3·H2O,n(NH4+)=0.02mol,c(NH4+) =0.2mol/L。当 V(NaOH)=50mL时溶质为NaCl,n(Cl-)= n(Na+)=0.1mol,即c(Cl-) =1mol/L。
考点:离子方程式的有关计算
点评:本题考查学生利用图象及离子反应来计算,明确图象中每一段曲线对应的化学反应是解答本题的关键,然后利用离子反应计算即可解答,B项是解答的难点。
本题难度:一般
4、选择题 下列指定反应的离子方程式正确的是
A.Na2SO3溶液中滴加稀H2SO4:SO32- + 2H+=SO2↑+ H2O
B.向AlCl3溶液中滴入足量的浓氨水:Al3+ + 4OH- = AlO2- + 2H2O
C.Ca(ClO)2溶液中通入少量CO2:2ClO- + CO2 + H2O ="2HClO" + CO32-
D.Fe(NO3)2溶液中加入过量的HI溶液:2Fe3++2I—=2Fe2++I2
参考答案:A
本题解析:
试题分析:A、亚硫酸钠与稀硫酸反应生成硫酸钠、水和二氧化硫气体,符合离子方程式的书写,正确;B、氢氧化铝不溶于氨水,所以不会生成偏铝酸根离子,错误;C、次氯酸钙与少量二氧化碳反应生成碳酸钙与次氯酸,所以应产生碳酸钙沉淀,错误;D、Fe(NO3)2溶液中加入过量的HI溶液,则该溶液中相当于存在硝酸,硝酸的氧化性大于铁离子的氧化性,所以硝酸根离子也会参与氧化还原反应,错误,答案选A。
考点:考查离子方程式书写正误的判断
本题难度:一般
5、选择题 下列离子方程式正确的是
A.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
B.少量金属钠放入冷水中:Na + 2H2O = Na+ + 2OH- + H2↑
C.氧化铜溶于硫酸:O2
参考答案:
本题解析:
本题难度:一般