微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在透明溶液中,下列各组离子能大量共存的是( )
A.HCO3-、Na+、K+、OH-
B.Na+、CO32-、NO3-、H+
C.K+、Cu2+、Cl-、SO42-
D.OH-、NH4+、Cl-、SO32-
参考答案:A.HCO3-与OH-反应而不能大量共存,故A错误;
本题解析:
本题难度:一般
2、选择题 若溶液中由水电离的c(OH-)=1×10-14mol/L,则在此溶液中一定不能大量共存的离子组是
A.Al3+ Na+ NO3- Cl-
B.K+ Na+ Cl- NO3-
C.K+Na+SO32-NO3-
D.K+NH4+SO42-HCO3
参考答案:D
本题解析:
试题分析:溶液中由水电离的c(OH-)=1×10-14mol/L ,说明溶液中存在大量的氢离子或氢氧根离子。A、该组离子在碱性条件下铝离子不能大量共存,在酸性条件下可以大量共存,正确;B、该组离子在酸性或碱性条件下都能大量共存,正确;C、该组离子中的亚硫酸根离子与氢离子反应,所以在酸性条件下不能大量共存,但在碱性条件下可以大量共存,正确;D、该组离子中的碳酸氢根离子在酸性或碱性条件下都不能大量共存,也碳酸氢根离子与氢离子或氢氧根离子都反应,错误,答案选D。
考点:考查离子大量共存的判断
本题难度:一般
3、选择题 在强酸性的溶液中,下列各组离子可以大量共存的是
A.K+、Ba2+、Cl-、NO3-
B.Ca2+、Al3+、HCO3-、Cl-
C.Na+、AlO2-、OH-、SO42-
D.K+、NH4+、NO3-、Fe2+
参考答案:A
本题解析:
B.H+和HCO3-在溶液中不能大量共存;
C.H+和OH-在溶液中不能大量共存;
D.H+和NO3-具有强氧化性,能氧化Fe2+。
点评:考查离子共存。离子共存,即不反应,无沉淀,无气体,无弱电解质生成;
本题难度:一般
4、选择题 已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸的化学式
| CH3COOH
| HCN
| H2CO3
|
电离平衡常数(25℃)
| 1.8×10-5
| 4.9×10-10
| K1=4.3×10-7
K2=5.6×10-11
则下列有关说法正确的是
A.各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
B.a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO)
参考答案:D
本题解析:
试题分析:根据弱酸的电离平衡常数可知,酸性强弱顺序是CH3COOH>H2CO3>HCN>HCO。由于酸越弱,相应的钠盐越容易水解,pH越大。A不正确,因为溶液的浓度不一定是相同的;根据溶液中电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(CN-),由于所得溶液中c(Na+)>c(CN-),所以c(H+)<c(OH-),因此溶液显碱性,但当二者恰好反应时,生成的盐水解,溶液也是显碱
本题难度:一般
5、选择题 下列反应的离子方程式正确的是
A.饱和FeCl3溶液滴入沸水中:Fe3+ + 3H2O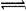 Fe(OH)3↓+ 3H+ Fe(OH)3↓+ 3H+
B.硫酸氢钠溶液中加入氢氧化钡溶液至溶液pH=7:Ba2+ + SO42-= BaSO4↓
C.氯化铝溶液中加入过量的氨水:Al3+ + 4OH-= AlO2-+ 2H2O
D.氯化亚铁溶液中滴入溴水:2Fe2+ + Br2 = 2Fe3+ +2Br-
参考答案:D
本题解析:
正确答案:D
A.不正确,饱和FeCl3溶液滴入沸水中:Fe3+ + 3H2O? Fe(OH)3(胶体)+ 3H+ Fe(OH)3(胶体)+ 3H+
B.不正确,硫酸氢钠溶液中加入氢氧化钡溶液至溶液pH=7:2H++2OH―+Ba2+ + SO42-= BaSO4↓+2H2O
C.不正确,氯化铝溶液中加入过量的氨水:Al
本题难度:一般
|