微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列图示与对应叙述相符的是

A.图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化
B.图②表示压强对可逆反应A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图③中曲线表示反应3A(g) + B(g) 2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
D.据图④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
参考答案:B
本题解析:
试题分析:A. 氨水是弱电解质,电离产生的离子的浓度较小,所以导电能力较弱,当向其中加入等浓度的醋酸时发生反应:CH3COOH+NH3·H2O=CH3COONH4+H2O。CH3COONH4是容易溶解的强电解质,在水中完全电离,自由移动的离子浓度增大,导电能力增强,当加入的醋酸溶液的体积与氨水相同时二者恰好完全反应。在完全反应之前,溶液的导电性显著增强,之后再加入醋酸,就不能再发生反应,醋酸溶液对原来的溶液还起到了稀释作用,所以导电能力还有所减小,不会是没有多大的变化。错误。B. 对于有气体参加的
本题难度:一般
2、填空题 KClO3与NaHSO3间的氧化还原反应生成Cl-和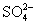 的速率与时间关系如下图,已知反应速率随c(H+)的增加而加快,试说明
的速率与时间关系如下图,已知反应速率随c(H+)的增加而加快,试说明

?(1)为什么反应开始时,反应速率增大?
(2)反应后期,反应速率逐渐降低的主要原因是___________。
参考答案:见解析
本题解析:KClO3与NaHSO3间的氧化还原反应为: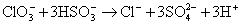 。显然,该反应有H+生成,且随着反应的进行,H+的物质的量浓度会越来越大。所以,反应开始时,反应速率逐渐增大。到了反应后期,
。显然,该反应有H+生成,且随着反应的进行,H+的物质的量浓度会越来越大。所以,反应开始时,反应速率逐渐增大。到了反应后期,
本题难度:简单
3、选择题 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe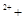 H2O2
H2O2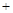 2H
2H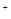 → 2Fe
→ 2Fe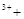 2H2O 2Fe
2H2O 2Fe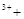 H2O2 → 2Fe
H2O2 → 2Fe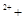 O2↑
O2↑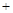 2H
2H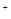
下列说法正确的是( )
A.H2O2的氧化性比Fe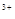 强,其还原性比Fe
强,其还原性比Fe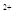 弱
弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe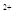 和Fe
和Fe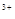 的总量保持不变
的总量保持不变
D.H2O2生产过程要严格避免混入Fe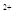
参考答案:CD
本题解析:首先要明确铁离子是起催化剂的作用,两个反应相加得2H2O2=2H2O+O2↑。因此在分解过程中H+的浓度不变,故溶液的pH不变。由于双氧水的量远大于亚铁离子,而且两个反应循环进行,故亚铁离子、铁离子的总量不变。在双氧水的生成中要避免其分解,故D的说法正确。对于A选项,第一个反应是在酸性条件下,得出的结论是正确的,但是第二个反应是在中性条件下进行的,得出的结论相反,故要比较其氧化还原性要指明反应条件的介质。答案选CD。
本题难度:一般
4、选择题 亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但遇酸性溶液发生分解: 5HClO2 = 4ClO2↑ + H+ + Cl-+ 2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,一段时间产生气体速度较快,速度变化的原因是 [???? ]
A.逸出ClO2使生成物浓度降低
B.酸使亚氯酸的氧化性增强
C.溶液中的H+起催化作用
D.溶液中的Cl-起催化作用
参考答案:D
本题解析:
本题难度:一般
5、选择题 为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是( )
A.将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同
B.盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快
C.将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快
D.升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
参考答案:A
本题解析:影响化学反应速率的主要因素是反应物的性质,镁、铝的活泼性不同,故两者与同浓度的盐酸反应快慢不同。
本题难度:一般