微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质中熔点最高的是
A.干冰
B.氯化钠
C.金刚石
D.汞
参考答案:C
本题解析:
本题考查物质的熔点比较。金刚石是原子晶体,熔点达3550℃,熔点最高,选C选项。
本题难度:简单
2、选择题 下列有关实验原理或操作正确的是

A.图1装置可用于分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃)的混合物
B.提纯混有少量Ba(NO3)2的KNO3溶液,可加入过量的K2CO3溶液,过滤后,在溶液中加入适量盐酸
C.图2装置用于吸收多余氨气
D.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
参考答案:C
本题解析:分析:A.根据蒸馏分离沸点相差较大的液体混合物,蒸馏装置中温度计的下端位于蒸馏烧瓶的支管口;
B.根据除杂的原理,即除去杂质不能引入新的杂质,若引入了新的杂质,应用方法将其除尽来;
C.根据氨气不溶于四氯化碳,能与硫酸反应,可用此装置防倒吸;
D.根据二氧化硅能与氢氧化钠反应;
解答:A.乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的是沸点相差较大,可可蒸馏分离,但蒸馏装置中温度计的下端位于蒸馏烧瓶的支管口,不能插入溶液,故A错误;
B.提纯混有少量Ba(NO3)2的KNO3溶液,可加入过量的K2CO3溶液,过滤后,在溶液中加入适量硝酸,故B错误;
C.氨气不溶于四氯化碳,能与硫酸反应,可用此装置防倒吸,故C正确;
D.瓷坩埚中含有的二氧化硅能与氢氧化钠反应,所以不可在瓷坩埚中熔化氢氧化钠固体后进行测量,故D错误;
故选:C;
点评:本题主要考查了物质的分离和提纯、物质的吸收等,难度不大,注意实验的原理是解题的关键.
本题难度:困难
3、选择题 下列物质中,含有非极性共价键的化合物是:
A.Na2O2
B.NaCl
C.NaOH
D.Br2
参考答案:A
本题解析:A中的Na2O2,钠离子与过氧根之间是离子键,而过氧根离子内部两个氧原子间是非极性共价键.
B选项, NaCl中只有离子键.
C选项,NaOH中钠离子与氢氧根离子之间是离子键,而氢氧元素间是极性共价键.
D选项, Br2是同种元素构成的双原子单质分子,含非极性共价键.
本题难度:一般
4、选择题 把1mL0.1mol/L的H2SO4溶液加入蒸馏水中,制成200ml溶液,稀释后的H2SO4中,由水自身电离产生的c(H+)最接近:
A.1×10-13mol/L
B.1×10-3mol/L
C.1×10-7mol/L
D.1×10-11mol/L
参考答案:D
本题解析:由C1V1=C2V2,得:C(稀释后H2SO4)= 5×10-4mol/L,即C酸(H+)= 1×10-3mol/L
(酸性溶液可忽略[H+]水)代入Kw=[H+][OH-],得:[OH-]=1×10-11mol/L=[OH-]水?
因为: H2O 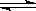 ?H++OH-,所以:[H+]水==[OH-]水=1×10-11mol/L,故选D
?H++OH-,所以:[H+]水==[OH-]水=1×10-11mol/L,故选D
本题难度:一般
5、选择题 下列物质的熔、沸点高低顺序正确的是
A.金刚石>晶体硅>二氧化硅>碳化硅
B.Cl4>CBr4>CCl4>CF4
C.K2O>Na2O>O2>N2
D.干冰 >二氧化硅>氯化钠>钠
参考答案:B
本题解析:一般情况下原子晶体的熔沸点最高,其次是离子晶体(或金属晶体),分子晶体的熔沸点最低。A全部是原子晶体,形成原子晶体共价键的原子半径越小,共价键越强,原子半径是Si>C>O,所以应该是金刚石>碳化硅>二氧化硅>晶体硅,A不正确。B中全部是分子晶体,对于组成和结构相似的分子晶体来讲,相对分子质量越大,熔沸点越高,因此B正确。形成离子晶体的离子键越强,熔沸点越高。形成离子键的离子半径越小,所带电荷数越多,离子键越强,所以C中的正确顺序为Na2O> K2O >O2>N2,C错误。D中应为二氧化硅>氯化钠>钠>干冰,所以正确的答案是B。
本题难度:一般