微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 20.6gNH4HCO3和NaHSO3的干燥粉状混合物,用加热分解的实验方法来测定NH4HCO3的质量分数。已知:NaHSO3加热时会产生SO2。根据下图所示的仪器和所盛试剂填空:
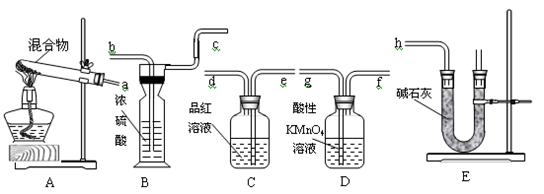
(1)按照气流由左→右的方向连接仪器的顺序(用a~h表示)为____________________。
(2)仪器B的名称为_________,E装置中放碱石灰的仪器名称为________,A和E装置中都用到的仪器名称为__________。
(3)D的作用是_______________________________________________________。
(4)C的作用是_________________________________;若C瓶中溶液颜色有变化,则测定结果可能会偏__________。
(5)B的作用是_____________________________________。
参考答案:(1)agfedbch??(2)洗气瓶,U形管,铁架台
本题解析:略
本题难度:简单
2、填空题 某兴趣小组用下图装置探究氨的催化氧化
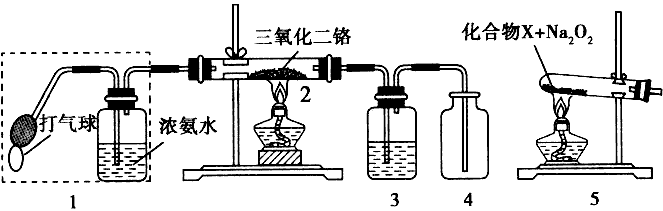
(1)氨催化氧化的化学方程式为________________。
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是____反应(填“吸热”或“放 热”)。
(3)为保证在装置4中观察到红棕色气体,装置3应装入_____;若取消3,在4 中仅观察到大量白烟,原因是___________________。
(4)为实现氨催化氧化,也可用装置5替换装置____(填装置代号);化台物X 为____(只写一种),Na2O2的作用是____。
参考答案:(1)![]() 本题解析:
本题解析:
本题难度:一般
3、填空题 Fe、Cu都是人类最早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题:
⑴ 甲同学取一束细铜丝用砂纸打磨后在酒精灯上加热至红热,再伸到盛Cl2的集气瓶中。你认为甲同学在实验中应该观察到的现象是??????????????????????????????;
⑵ 乙同学为验证Fe能和热的浓HNO3反应,设计了如下图所示的实验装置,请你指出装置中的不足之处???????????????????????????;???????????????????????????????;
??????????????????????????????????????。

⑶ 丙同学在Fe和浓HNO3反应后的溶液中加入一块Cu片,Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解。
丙同学依据反应现象得出Cu片溶解的原因可能是和HNO3发生反应。他依据的反应现象是????????????????????????????????????????????????????????;请写出Cu片和稀HNO3反应的离子方程式?????????????????????????????????????????????????????????
你认为Cu片溶解的不同于丙同学的理由是??????????????????????????????????????????????????????
⑷ 请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象??????????????????????????????????????????????????????????
??????????????????????????????????????????????????????????????????????。
参考答案:(1)Cu在Cl2中燃烧,产生棕色烟(1分)
(2)试
本题解析:略
本题难度:简单
4、实验题 实验室用稀硝酸与Cu反应来制备NO气体,如果采用图(Ⅰ)装置,由于烧瓶内的空气不易排出,生成的NO很快被氧化成红棕色的NO2,不易观察到有无色的NO生成。即使可用排水法收集到无色的NO,也无说服力,学生会认为NO是由NO2与H2O反应生成的。有人设计了图(Ⅱ)装置,用来做该实验可以达到满意的效果。
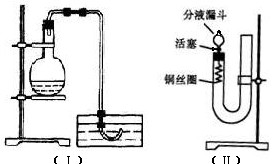
(1)将有关操作补充完全:
①将活塞打开,从U形管的长管口注入稀硝酸,一直注到_______________________为止。
②关闭活塞,用酒精灯在____________加热,当___________时,立即撤去酒精灯。
( 2)回答下列问题:
2)回答下列问题:
①该反应为_________反应。(“吸热”、“放热”)
②反应在什么情况下可以自动停止?可以在何处观察到无色的NO气体?
______________________________________________________________________;
③如果再将活塞慢慢打开,可立即观察到哪些明显现象?
_______________________________________________________________________;
④如果需要再获得NO与已生成的NO2形成鲜明对照的实验效果,应_________(填操作)。
参考答案:(1)①液面接触分液漏斗活塞下沿??(1分)
②U型管
本题解析:略
本题难度:简单
5、填空题 三氯异氰尿酸(结构简式如图)是一种极强的氧化剂和氯化剂。
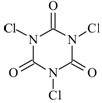
(1)利用三氯异氰尿酸水解产物中的氧化性物质X可消毒灭菌,X的分子式为???????。
(2)“有效氯”含量指从KI中氧化出相同量的I2所需Cl2的质量与指定化合物的质量之比,常以百分数表示。为测定三氯异氰尿酸的“有效氯”含量,现称取某三氯异氰尿酸样品0.5680 g,加水、足量KI、硫酸,配制成100 mL待测液;准确量取25.00 mL待测液于碘量瓶中,用0.1500 mol·L-1 Na2S2O3标准溶液滴定至溶液呈微黄色时,加入淀粉指示剂,继续滴定至终点(发生反应的方程式为:2Na2S2O3+I2=Na2S4O6+2NaI);重复测定2次,所得的相关数据如下表:
滴定序号
| 待测液体积/mL
| 标准液滴定管起点读数/mL
| 标准液滴定管终点读数/mL
|
1
| 25.00
| 0.06
| 24.04
|
2
| 25.00
| 0.02
| 24.02
|
3
| 25.00
| 0.12
| 24.14
?
①滴定终点观察到的现象为???????;
②配制0.1500 mol·L-1 Na2S2O3溶液100 mL,所需Na2S2O3·5H2O的质量为???????;
③计算此样品的“有效氯”含量(写出计算过程)。
参考答案:
(1)HClO(2分)
(2)①溶液蓝色褪去,
本题解析:
试题分析:(1)三氯异氰尿酸中氯原子水解,氯原子结合羟基,生成HClO,其具有强氧化性;(2)①碘溶液加入淀粉为蓝色,终点时溶液蓝色褪去,且30 s内不变色;
②所需Na2S2O3·5H2O的质量为0.1500 ×0.1×248="3.72" g
③3次消耗标准Na2S2O3溶液的平均值为24.00 mL
根据反应:Cl2+2I-=2Cl-+I2,2Na2S2O3+I2=Na2S4O6+2NaI
确定关系式Cl2——I2——2Na2S2O3
n(Cl2)=4×(1/2×0.1500 mol·L-1×24.00×10-3 L) =7.2×10-3 mol(2分)
m(Cl2)=7.2×10-3 mol×71 g·mol-1=0.5112 g(2分)
本题难度:一般
|