微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列分子中的中心原子发生sp2杂化的是[???? ]
A.CH4
B.NH3
C.H2O
D.BF3
参考答案:D
本题解析:
本题难度:简单
2、选择题 以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
[???? ]
A.
B.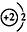
C.1s2
D.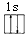
参考答案:D
本题解析:
本题难度:简单
3、填空题 (三选一)【选修3:物质结构与性质】
碳、氮、氧是构成生命物质的三种主要元素。
(1)碳、氮、氧三种元素中,原子核外电子未成对电子数最多的是____________(用元素符号表示)。
(2)尿素[CO(NH2)2]和乙酸(CH3COOH)的相对分子质量均为60,但状态却不同,常温下尿素为稳定的固体,乙酸为易挥发的液体。出现这种现象的原因是______________________________________。
(3)CH4、NH3、H2O三种氢化物分子中的中心原子碳原子、氮原子、氧原子的杂化状态是否相同__________,三种分子中的键角大小顺序是__________(用化学式表示)。
(4)MgO与NaCl晶胞同为面心立方结构,MgO晶胞体积为7.62×10-23cm3,NA=6.02×1023mol-1,那么MgO的晶胞密度为____________g/cm3(保留两位小数,密度=品胞中MgO的质量/晶胞体积)。
参考答案:(1)N
(2)尿素分子形成了大量的分子间氢键,而乙酸
本题解析:
本题难度:一般
4、填空题 生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式____。
(2)根据等电子原理,写出CO分子的结构式____。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是___ ;甲醛分子中碳原子轨道的杂化类型为_______________。
②甲醛分子的空间构型是_____;1 mol甲醛分子中σ键的数目为__________________。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为_____________________。
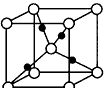
参考答案:(1)![]() 本题解析:
本题解析:
本题难度:一般
5、填空题 已知a、b、x、y、z五种元素的原子序数依次增大,其中a原子的半径是所有原子中半径最小的,b原子中的电子有6种不同的运动状态,y原子的L层有2对成对电子,z元素的电负性是前四周期中最小的。
(1)x、y两种元素的第一电离能的大小为x________y(填“>”、“<”或“=”),用原子结构的知识解释原因________________________;
(2)固体物质M的化学式为xa5?,它的所有原子最外层都符合相应的稀有气体原子的最外电子层结构。则该化合物中a元素的化合价为_______和______;该化合物中x原子的杂化方式为__________;
(3)如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,z原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。现把C60?抽象成质点,该晶体的晶胞结构如图所示,若每个四面体空隙填入一个z元素的原子,则?z元素全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为_____________。
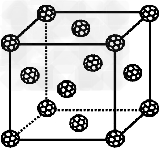
参考答案:(1)>;O原子的价电子排布为2s22p4,N原子的价
本题解析:
本题难度:一般