微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 建筑用的红砖和青砖,其颜色是由其中含有的不同价态的铁氧化物所致。我国古代砖瓦建筑能够保持到现在的,几乎无一例外的是由青砖建成。有人提出以下可能的原因:
①青砖中含的是FeO;②青砖中含的是Fe3O4;③Fe2O3遇长期酸雨侵蚀会风化溶解使砖瓦强度降低;④Fe3O4性质稳定;⑤FeO性质稳定。你认为有道理的是
A.①③⑤
B.②③④
C.③⑤
D.①②③④⑤
参考答案:A
本题解析:
试题分析:青砖是加水缺氧条件下生成的还原剂氢气和一氧化碳把氧化铁还原为低价的氧化亚铁所致,其抗氧化性和抗腐蚀性均增强。
本题难度:一般
2、选择题 m g铁粉与Fe2O3组成的混合物投入到足量的稀H2SO4中,在标准状况下收集到V L H2,所得溶液遇KSCN溶液不显红色,则混合物中Fe2O3物质的量为( )
参考答案:B
本题解析:设氧化铁的物质的量是x,则与铁离子反应的单质铁是x。又因为生成氢气是V/22.4mol,所以原混合物中铁的物质的量是V/22.4mol+x,因此有(V/22.4+x)×56+160x=mg。解得x= mol ,所以选B。
本题难度:简单
3、选择题 从经济效益和环境保护的观点出发,由铜制取硝酸铜最适宜的方法是(????????)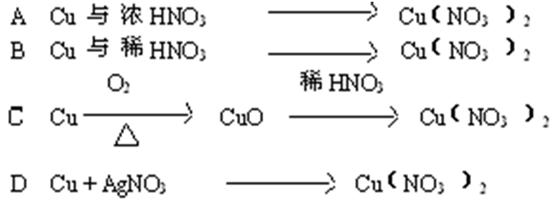
参考答案:C
本题解析:略
本题难度:简单
4、选择题 在CuO和铁粉的混合物中,加入一定量的稀硫酸并微热。当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,发现铁钉并无任何变化。根据上述现象,确定下列结论中正确的是( )
A.不溶物一定是Cu
B.不溶物一定含铜,但不一定含铁
C.不溶物一定是Fe
D.溶液中一定含有Fe2+,但不一定含有Cu2+
参考答案:B
本题解析:涉及反应为:
CuO+2H+=Cu2++H2O???? Fe+2H+=Fe2++H2↑??? Fe+Cu2+=Fe2++Cu
向向滤液中插入一枚铁钉,发现铁钉并无任何变化,说明滤液中已经不含H+、Cu2+,那么铜元素已经全部存在于不溶物中;
如果铁过量,不溶物中也可能含有铁,故答案为B
本题难度:一般
5、填空题 (15分)聚合硫酸铁又称聚铁,化学式为 ,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
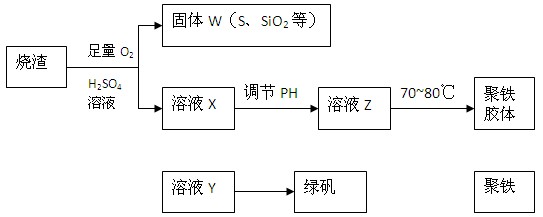
(1)验证固体W焙烧后产生的气体含有SO2的方法是___。
(2)制备绿矾时,向溶液X中加入过量___,充分反应后,经_____操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。
(3)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为____。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏_____。
(4)古代将绿矾煅烧可制绿矾油(也叫镪水,即硫酸)和红色颜料(Fe2O3),请写出有关的化学方程式:
????????????????????????????????????????????????????????????????????????。
(5)绿矾还可用以下方法生产红色颜料(Fe2O3),其具体操作流程是:将5560kg绿矾(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入16680 kg 绿矾和560 kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料____________________kg。
参考答案:(1)将气体通入品红溶液中,如品红褪色,加热后又变红,注明有
本题解析:(1)二氧化硫具有漂泊性可以使品红溶液褪色,但其漂白不是很稳定,加热后又可恢复原来颜色。
(2)溶液X中含有Fe3+,必须除去,但又不能引入新的杂质,可选用铁粉,过量的铁粉通过过滤除去.
(3)检验溶液的pH值是一定不能先润湿pH试纸,也不能插入到溶液中,正确的方法是将试纸放到表面皿上,用玻璃棒蘸取溶液,点到试纸的中央,然后根标准比色卡对比。若溶液Z的pH偏小,说明酸性较强,会是的聚铁中氢氧根偏少,硫酸根偏多,因而铁的质量分数偏低。
(4)依据题意可得该反应属于氧化还原反应,有二氧化硫生
本题难度:简单