微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室需用2mol·L-1氯化钠溶液450 mL,配制时应选用容量瓶的规格和称取氯化钠的质量分别是
A.450 mL,52.7 g
B.500 mL,58.5 g
C.450 mL,58.5 g
D.500 mL,52.7 g
2、选择题 下列实验操作中完全正确的是
编号
| 实验
| 操作
|
A
| 钠与水反应
| 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中
|
B
| 排除碱式滴定管尖嘴部分的气泡
| 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出
|
C
| 配制一定浓度的氯化钾溶液1000mL
| 准确称取氯化钾固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀,定容
|
D
| 取出分液漏斗中所需的上层液体
| 下层液体从分液漏斗下管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出
?
3、实验题 重铬酸钠(Na2Cr2O7·2H2O)俗称红矾钠,是一种重要的无机盐产品,可作氧化剂,在印染、颜料、电镀、医药等工业方面有广泛的用途。某化学兴趣小组设计实验测定市场上的红矾钠中Na2Cr2O7的质量分数,其步骤如下:
I.称取Wg红矾钠,溶于酸配成l00mL溶液;
Ⅱ.用cmol·L-1的标准KMnO4酸性溶液滴定20.00mL一定浓度的FeSO4溶液,消耗KMnO4溶液20.00rnL;
Ⅲ。取20.00mL Na2Cr2O7溶液,用上述FeSO4溶液滴定,达到滴定终点时,消耗24.00mLFeSO4溶液;
查阅资料知:Cr2O72-在酸性条件下具有强氧化性,易被还原为Cr3+
回答下列问题:
(1)Na2Cr2O7与FeSO4的反应离子方程式为???????????.
(2)步骤Ⅱ中的滴定过程,滴定终点的现象为???????;选用??????(填“酸式”或“碱式”)滴定管。
(3)已知:MnO4-+5Fe2++8H+==Mn2++5Fe3++4H2O,此红矾钠中Na2Cr2O7的质量分数的表达式为?????????。
(4)判断下列操作对Na2Cr2O7的质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”):
①步骤Ⅲ中的滴定过程,滴定终点读数时俯视读数??????;
②配制c mol·L-1的KMnO4标准溶液时,转移时有少量溶液洒出???????。
(5)[实验探究]有同学提出FeSO4有很强的还原性,在空气中易被氧化而变质,因此对测定结果会造成影响,请你分析后指出,如果FeSO4变质,对测定结果的影响是??????(填“偏高”、“偏低”或“无影响”)。
请设计一个简单实验检验FeSO4溶液是否变质??????????????。
4、选择题 在配制一定物质的量浓度的NaCl溶液时,下列操作会造成所配溶液浓度偏高的是
A.在用托盘天平称量所需NaCl的质量时,左盘放砝码右盘放NaCl
B.定容时俯视刻度线
C.转移时,把烧杯和玻璃棒用蒸馏水洗涤并把洗涤液也转移至容量瓶
D.容量瓶中有少量水,转移溶液前将容量瓶烘干
5、实验题 亚硝酸盐是一祌常见的食品添加剂,使用时必须严格控制其用量。为检测某食品中亚硝酸盐含量(通常以1kg样品中含NaNO2的质量计),某研究小组设计了如下两种实验方案: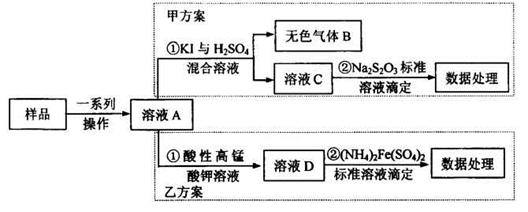
(1)无色气体B遇空气显红棕色,B的化学式为_______写出甲方案①中反应的离子方程式_______
(2)完成并配平乙方案①中反应的离子方程式
MnO4-+??NO2-+?????????=???Mn2++???NO3-+?????????,
(3)乙方案②中需配置100mL0.0010mol/L(NH4)2Fe(SO4)2标准溶液,在已准确称量样品的质量后,还需要的仪器有:量筒、烧杯、_______配制溶液时,定容的操作方法是______
(4)若取样品ag,按乙方案进行测定,准确量取12.00mL0.0005mol/L的酸性高锰酸钾溶液(过童)与溶液A反应。反应后溶液用0.0010mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色溶液刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液10.00mL.则1kg样品中NaNO2的质量为_______mg.
|