微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是
A.M
B.M2+
C.M3+
D.MO2+
参考答案:B
本题解析:试题分析:0.195g锌粉恰好反应转移电子数0.006mol,则20.0mL的0.100 mol·L-1MO2+得电子0.006mol,因此M的化合价由+5降低为+2价,所以B选项正确。
考点:考查了氧化还原的计算。
本题难度:简单
2、选择题 为保护地下钢管不受腐蚀,可使它与
①直流电源负极相连???????????②铜板相连
③锌板相连???????????????????④直流电源正极相连
A.①②
B.③④
C.①③
D.②④
参考答案:C
本题解析:本题考查的是金属的电化学防护方法:①外加电流阴极保护法:把金属连接在电源的负极上,这样就能消除引起金属腐蚀的原电池反应;②牺牲阳极保护法:在金属上铆接比它更活泼的另一金属,发生金属腐蚀而金属本身受到保护。所以选①③,C正确。
本题难度:困难
3、填空题 (9分)水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2)在pH=1的水溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3- ④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(3)在下列反应中,水仅做氧化剂的是 ,水既不做氧化剂又不做还原剂的是 。
A.2F2+2H2O=4HF+O2
B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑
D.3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
(4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为 ,反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数为 。
参考答案: (1)  本题解析:
本题解析:
试题分析:(1)H2O是共价化合物,用电子式表示H2O的形成过程是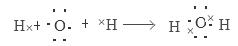 ,(2)在pH=1的酸性水溶液中,①NH4+、Al3+、Br-、SO42-不会发生任何反应,可以大量共存,正确;② 在酸性溶液中H+、Fe2+、NO3-会发生氧化还原反应而不能大量共存,错误;③在酸性溶液中K+、Ba2+、Cl-、NO3-不会发生任何反应,可以大量共存,正确;④在酸性溶液在中H+、HCO3-会发生复分解反应而不能大量共存,错误。因此一定大量共存的是①③;(3)在反应CaH2+2H2O=Ca(OH)2+2H2↑ 和3Fe+4H2O
,(2)在pH=1的酸性水溶液中,①NH4+、Al3+、Br-、SO42-不会发生任何反应,可以大量共存,正确;② 在酸性溶液中H+、Fe2+、NO3-会发生氧化还原反应而不能大量共存,错误;③在酸性溶液中K+、Ba2+、Cl-、NO3-不会发生任何反应,可以大量共存,正确;④在酸性溶液在中H+、HCO3-会发生复分解反应而不能大量共存,错误。因此一定大量共存的是①③;(3)在反应CaH2+2H2O=Ca(OH)2+2H2↑ 和3Fe+4H2O Fe3O4+4H2中水仅做氧化剂;在2Na2O2+2H2O=4NaOH+O2↑中,水既不做氧化剂又不做还原剂;(4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,燃料氢气的电极是负极,则负极的电极反应为H2 +2OH - -2e =2H2O;反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,则由于n(H2O)=1800g÷18g/mol=100mol根据原电池的电极反应可知,每产生1mol的水,转移电子2mol,现在产生来 100mol的水,所以电池内转移的电子数为200NA。
Fe3O4+4H2中水仅做氧化剂;在2Na2O2+2H2O=4NaOH+O2↑中,水既不做氧化剂又不做还原剂;(4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,燃料氢气的电极是负极,则负极的电极反应为H2 +2OH - -2e =2H2O;反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,则由于n(H2O)=1800g÷18g/mol=100mol根据原电池的电极反应可知,每产生1mol的水,转移电子2mol,现在产生来 100mol的水,所以电池内转移的电子数为200NA。
考点:考查有关水的结构、性质及应用和计算的知识。
本题难度:困难
4、选择题 下列说法中正确的是
A.1molO2的质量为32g·mol-1
B.1molOH-的质量为17
C.CO2的相对分子质量为44g
D.H2O的摩尔质量为18g·mol-1
参考答案:D
本题解析:A错误,单位错误,1molO2的质量为32g
B错误,单位错误,1molOH-的质量为l7g
C错误,相对分子量没有单位,CO2的相对分子质量为44。
D正确。
本题难度:简单
5、填空题 (1)在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,_________是氧化剂, _______是还原剂,HCl表现的性质是_______和________,1mol K2Cr2O7反应转移电子的物质的量是_________。
(2)下列物质中①食盐水②NaOH ③Cu ④HCl气体⑤空气 ⑥酒精 ⑦CO2⑧KNO3属于电解质的是 (填序号,下同);属于非电解质的是 。
参考答案:(1)K2Cr2O7 H
本题解析:
试题分析:(1)在该反应中K2Cr2O7作氧化剂发生还原反应,产生还原产物CrCl3;HCl作还原剂发生氧化反应,产生氧化产物Cl2。在参加反应的14mol的HCl中只有6mol作还原剂,还有8mol其酸的作用。每摩尔K2Cr2O7反应转移电子6mol.(2)电解质是在水溶液里或融化状态下能导电的化合物。非电解质是在水溶液里和融化状态下都不能导电的化合物。化合物属于纯净物。所以电解质、非电解质都必须是纯净物。①食盐水⑤空气是混合物。③Cu是单质。都不能选择。电解质是②④⑧ 非电解质的是⑥⑦。
考点:考查氧化还原反应的实质、特征、反应类型及电解质、非电解质的概念的知识。
本题难度:一般