微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中,与100 mL 0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
A.100 ml 0.5 mol/L MgCl2溶液
B.200 ml 0.25 mol/L HCl溶液
C.50 ml 1 mol/L NaCl溶液
D.200 ml 0.25 mol/L CaCl2溶液
参考答案:D
本题解析:略
本题难度:一般
2、选择题 (NA为阿伏加德罗常数的值) 下列说法正确的是( )
A.25℃时,pH=13的1.0L Ba(OH) 2溶液中含有的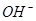 数目为0.2NA
数目为0.2NA
B.标准状况下,11.2L的戊烷所含的分子数为0.5NA
C.标准状况下,2.24 L Cl2溶于水中达到饱和,转移的电子数是0.1NA
D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA
参考答案:D
本题解析:
试题分析:A.25℃时,pH=13的1.0L Ba(OH) 2溶液中含有的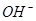 数目为0.1NA,错误;B.标准状况下,戊烷是液体,不能使用气体摩尔体积,错误;C.标准状况下,2.24 L Cl2溶于水中达到饱和,由于溶解于水的氯气只有一部分发生反应,实验转移的电子数小于0.1NA,错误;D.乙烯、丙烯、丁烯都属于烯烃,分子式通式是CnH2n,最简式是CH2,式量是14,所以14g乙烯、丙烯、丁烯的混合气体所含有的原子数为3NA,正确;
数目为0.1NA,错误;B.标准状况下,戊烷是液体,不能使用气体摩尔体积,错误;C.标准状况下,2.24 L Cl2溶于水中达到饱和,由于溶解于水的氯气只有一部分发生反应,实验转移的电子数小于0.1NA,错误;D.乙烯、丙烯、丁烯都属于烯烃,分子式通式是CnH2n,最简式是CH2,式量是14,所以14g乙烯、丙烯、丁烯的混合气体所含有的原子数为3NA,正确;
考点:考查阿伏加德罗常数的计算的知识。
本题难度:一般
3、选择题 下列说法正确的是(NA表示阿伏加德罗常数的值)
A.30g乙烷含有的共价键数目为8NA
B.标况下,22.4L己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA
C.1 mol甲基含10 NA个电子
D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
参考答案:D
本题解析:30g乙烷含有的共价键数目为7NA,标况下,己烷不是气体。1 mol甲基含9 NA个电子?, 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA。
本题难度:简单
4、填空题 计算(18分)
(1)同温同压下的两个相同容器中分别装有O2和O3气体,则两瓶气体中分子数之比
是?????,原子数之比是?????,质量之比是?????,密度之比是?????
(2)下列所给出的几组物质中:含有分子数最多的是????????;含有原子数最多的
是????????;标准状况下体积最大的是???????????。
① 1gH2;? ② 2.408×1023个CH4;③ 10.8gH2O; ④ 标准状况下6.72LCO2
(3)设NA表示阿伏加德罗常数,如果ag某气体含有的分子数是b,则cg该气体在
标准状况下的体积是????????????????(用含NA的式子表示)。
(4)配制100 mL 1mol/L的的稀H2SO4溶液,需要用量筒量取质量分数为98%的
浓H2SO4(密度为1.84g/cm3)的体积为?????????????。
参考答案:(1)1∶1;? 2∶3;? 2∶3;?? 2∶3;????
本题解析:
试题分析:(1)同温同压下的两个相同容器,说明V和Vm相同,根据n=V/Vm可知,n相同,故分子数之比是1:1;1molO2含有2mol的氧原子,1molO3含有3mol的氧原子,故当分子数相同时,原子数之比为2:3;质量=物质的量×相对分子质量,而物质的量相同,故质量之比等于相对分子质量,即为32:48=2:3;密度等于质量除以体积,体积相同的情况下,密度之比等于质量之比,故为2:3.
(2)、1gH2有0.5molH2,1molH,2.408×1023个CH4有0.4molCH4,有0.
本题难度:一般
5、选择题 标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为w,物质的量浓度为c mol/L,则下列关系中不正确的是[???? ]
A.ρ=(17V+22 400)/(22.4+22.4V)
B.w=17c/(1 000ρ)
C.w=17V/(17V+22400)
D.c=1000Vρ/(17V+22400)
参考答案:A
本题解析:
本题难度:简单