微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
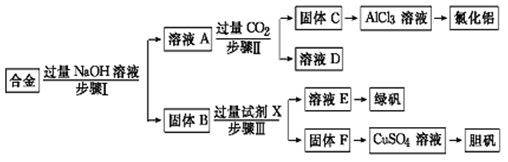
请回答:
(1)写出步骤Ⅰ反应的离子方程式: 。
(2)试剂X是 。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 。
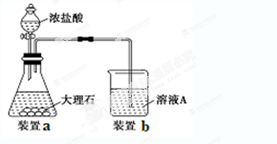
(3)进行步骤Ⅱ时,该小组用如下图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
(4)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式 ,请选出你认为的最佳途径并说明选择的理由 。
参考答案:(1)2Al+2OH—+2H2O=2AlO2-+3H2↑
本题解析:
试题分析:(1)合金废料含有铝、铁和铜,只有铝与碱反应:2Al+2OH—+2H2O=2AlO2-+3H2↑(2)固体B中含铁和铜,制取绿矾所以用稀硫酸或H2SO4;步骤Ⅰ、Ⅱ、Ⅲ均为固体与液体分离所以需进行的实验操作是过滤。
(3) 用浓盐酸制取CO2中会含有挥发出的HCl与Al(OH)3发生反应而出现沉淀消失的现象。应在装置Ⅰ、Ⅱ之间增加一个盛有饱和NaHCO3溶液的洗气瓶除去HCl气体。
(4)三种合成途径:
①反应为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
②反应为:Cu+O2+H2SO4=CuSO4+H2O
③反应为:Cu+2H2SO4=CuSO4+SO2↑+2H2O
所以途径②最佳,理由是原料利用率高,环境污染小
考点:了解常铁铝铜及其重要化合物的主要性质及其应用。
点评:物质制备流程试题,首先弄清楚流程过程中原料到产品的基本原理和除杂、分离提纯产品的化工工艺如本题中原料为铝、铁和铜的合金,产品为氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。然后再结合问题得出答案,解题过程注意题目提示信息如:“过量”、物质状态等。
本题难度:困难
2、选择题 下列反应对应的离子方程式中正确的是 ( )
A.铜与浓硝酸混合:Cu+4HNO3(浓)====Cu2++2 +2NO2↑+2H2O
+2NO2↑+2H2O
B.用惰性电极电解MgCl2溶液:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.NaHSO4溶液与Ba(OH)2溶液混合呈中性: +Ba2++2OH-====BaSO4↓+ +2H2O
D.氢氧化铜溶于氢溴酸:Cu(OH)2+2H+====Cu2++2H2O
参考答案:D
本题解析:A错,浓硝酸应拆成H+、NO3—离子;B错,用惰性电极电解MgCl2溶液正确的方程式为:Mg2++2Cl-+2H2O Cl2↑+H2↑+Mg(OH)2↓;C错,正确离子方程式为:H++SO42—+Ba2+=BaSO4↓+H2O;D正确,氢氧化铜为难溶于水的碱;
Cl2↑+H2↑+Mg(OH)2↓;C错,正确离子方程式为:H++SO42—+Ba2+=BaSO4↓+H2O;D正确,氢氧化铜为难溶于水的碱;
本题难度:一般
3、选择题 下列反应的离子方程式正确的是
A.澄清的石灰水跟盐酸反应:H++OH-="=" H2O
B.铁和稀硫酸反应:2Fe + 6H+ =2Fe 3+ +3H 2↑
C.NaHCO3溶液与NaOH溶液反应: OH-+ HCO3-=CO32-+ H2O
D.金属钠跟水反应: Na+2H2O ==Na++2OH-+H2↑
参考答案:AC
本题解析:
试题分析:A.澄清的石灰水和盐酸都是可溶性强电解质,强酸强碱中和反应,A正确;B.铁和稀硫酸反应生成亚铁盐:Fe + 2H+ =Fe 2+ +H 2↑,B错误;C.NaHCO3溶液与NaOH溶液反应,生成Na2CO3和水,C正确;D.电荷不守恒,应该为: 2Na+2H2O ==2Na++2OH-+H2↑,D错误;答案选AC。
考点:考查离子方程式的正误判断。
本题难度:一般
4、填空题 (16分)粉煤灰,是从煤燃烧后的烟气中收捕下来的细灰,粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物为:SiO2、Al2O3,还含有FeO、Fe2O3等。现将提取粉煤灰中Al、Si等元素,某科研小组的同学设计了如下工艺流程:

请回答下列问题:
(1)操作i所需要的玻璃仪器有: (填序号)。
a.铁架台 b.烧杯 c.冷凝管 d.玻璃棒 e.集气瓶 f.分液漏斗 g.漏斗
(2)写出粉煤灰与过量NaOH溶液反应的离子方程式 。
(3)写出向固体A中加入过量稀H2SO4和过量H2O2时发生的离子反应方程式 。
(4)写出生成固体H的离子方程式 。
(5)该科研小组的同学准备用0.1 mol·L-1KSCN溶液和0.5000mol·L-1KI溶液滴定溶液B,以测定粉煤灰中Fe元素的含量:
①为减小实验误差,由固体A制备溶液B过程中煮沸的目的是
(请用化学方程式表示)。
②判断滴定终点的现象为 。
③将溶液B配制成250mL溶液后,取出25.00mL装入锥形瓶中,再滴入1~2滴KSCN溶液进行滴定,滴定过程中使用KI溶液的量如下表所示:
滴定次数
| 1
| 2
| 3
| 4
|
KI溶液体积/mL
| 30.00
| 32.20
| 30.02
| 29.98
则该粉煤灰中Fe元素的质量分数为 (保留三位有效数字)。
④若滴定操作太慢,则滴定结果 (填“偏小”、“偏大”或“无影响”);原因是
(请用离子方程式及简单的文字描述)。
参考答案:(1)b、d、g(选对2个得1分,全对得2分)。
(2
本题解析:(1)操作i是过滤,需要用到的玻璃仪器有:烧杯、玻璃棒、漏斗。
(2)粉煤灰中SiO2与Al2O3分别与过量NaOH溶液反应的离子方程式:SiO2+2OH-=SiO32-+H2O;Al2O3
+2OH-=2AlO2-+H2O。
(3)写出向固体A中加入过量稀H2SO4和过量H2O2的目的是将Fe2+氧化为Fe3+,发生反应的离子方程式为:H2O2+2H++2Fe2+=2Fe3++2H2O。
(4)固体H的主要成分Al2O3是溶液F中的Al3+与NH3反应生成的,其离子方程式为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
(5)①加热煮沸的目的是让过量的H2O2完全分解,以防止干扰后面的滴定实验,化学方程式为:2H2O2=2H2O+O2↑。
②以KSCN为指示剂,用标准KI溶液滴定未知的Fe3+,滴定终点的实验现象为:溶液的血红色刚好退去,且半分钟内颜色无变化。
③由表可知,第二次滴定数据是错误的,不能用来算平均体积,故舍去。滴定消耗KI溶液的平均体积为30.00mL,根据:
I- ~ Fe3+
1mol 56g
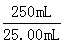 ×0.5000×30.00×10-3mol m(Fe3+) ×0.5000×30.00×10-3mol m(Fe3+)
m(Fe3+)=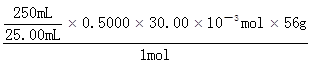 =8.40g =8.40g
所以w(Fe)=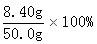 =16.8%。 =16.8%。
④滴定过慢,KI溶液被空气氧化,消耗KI溶液的体积增大,故滴定结果偏大;发生反应的离子方程式为:4H++4I-+O2=2I2+2H2O。
【猜题理由】本题来源于真实的化工工艺,废物中资源的回收、综合利用。该试题起点高、结构新颖,工
业背景的题材多、提问灵活,该类题符合考纲“能够从试题提供的新信息中,准确地提取实质性内容,考
查学生知识迁移的能力”。 将元素化合物知识放置在真实的化学工业环境中,从而达到考查同学们的综
合分析问题的能力以及将新信息和已有信息整合,重组为新信息块的能力。是新课改区高考题的一大“亮
点”。已成为课改省份必考题型之一。
【声明】本文属本人原创作品,本文著作权授予“北京凤凰学易科技有限公司”独家所有,本人拥有署名权。
本题难度:困难
5、填空题 I、(10分)现有下列电解质溶液:① Na 2CO3 ② NaHCO3 ③苯酚钠(不与碱反应) ④CH3COONH4 ⑤NH4HCO3
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号):
(2)已知:酸性H2CO3 > 苯酚> HCO3-。常温下,物质的量浓度相同的① 、②、 ③溶液pH大小顺序为(填写序号):
(3)写出⑤与足量NaOH溶液混合加热反应的离子方程式
(4)已知常温下CH3COONH4溶液呈中性,根据这一事实推测⑤溶液的pH 7(填>、=或<), 理由是:
II、(4分)室温时,向a mL 0.10 mol/L的稀氨水中逐滴加入 b mL 0.10 mol/L的稀盐酸,试分析:
(1)当b=a时,溶液呈________(填“酸”“碱”或“中”)性,此时溶液中,c(NH)________(填“>”“<”或“=”)c(Cl-).
(2)当溶液呈中性时,a________(填“>”“<”或“=”)b,此时溶液中c(NH)________c(Cl-)(同上).
参考答案:(14分)Ⅰ(10分)答案:(1)②④⑤ (2分)(漏选给1
本题解析:
试题分析:Ⅰ(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是②④⑤。
(2)酸越弱,相应的钠盐越容易水解,则根据酸性强弱顺序可知,常温下,物质的量浓度相同的① 、②、 ③溶液pH大小顺序为①>③>②。
(3)碳酸氢铵与足量NaOH溶液混合加热反应的离子方程式是2OH-+HCO3-+NH4+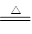 CO32-+2H2O+NH3↑。 CO32-+2H2O+NH3↑。
(4)常温下CH3COONH4溶液呈中性,这说明醋酸的酸性与NH3.H2O的碱性强弱相当,而碳酸酸性比醋酸弱,即碳酸的酸性比NH3.H2O的碱性弱,故NH4HCO3溶液显碱性。
II、(1)a=b,说明二者恰好反应生成氯化铵,氯化铵水解,溶液显酸性。根据电荷守恒可知c(NH)+c(H+)=c(OH-)+c(Cl-),所以c(NH)<c(Cl-)。
(2)当溶液呈中性时,说明氨水过量,因此a>b。根据电荷守恒可知c(NH)+c(H+)=c(OH-)+c(Cl-),所以c(NH)=c(Cl-)。
考点:考查离子方程式的书写、溶液酸碱性的判断以及溶液中离子浓度大小比较
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和学习方法的指导与训练,有利于培养学生的逻辑推理能力,提高学生的应试能力。该题的关键是利用好溶液中的几种守恒关系,即电荷守恒、物料守恒和质子守恒。
本题难度:一般
|