微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (13分)研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1,
C(s)+CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式: 。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度
下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
测得CH3OH的物质的量随时间的变化见图。
①
曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。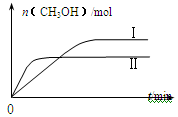
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器
| 甲
| 乙
| 反应物投入量
| 1molCO2、3molH2
| a molCO2、b molH2、
c molCH3OH(g)、c molH2O(g)
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂
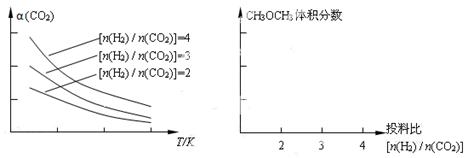
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图。在其他条件不变时,请在右图中画出平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图。 CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图。在其他条件不变时,请在右图中画出平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图。
参考答案:(1)Fe2O3(s) + 3CO(s)=2Fe(s) +
本题解析:
试题分析:(1)已知:①Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1,②C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1,则根据盖斯定律可知①—②×3即得到CO还原Fe2O3(s)的热化学方程式为Fe2O3(s) + 3CO(s)=2Fe(s) + 3CO2(g) ΔH 1=—28.5kJ·mol-1。
(2)原电池中负极失去电子,则CO在负极通入,电解质显碱性,则该电池的负极反应式为CO+4OH——2e—=CO32—+2H2O。
(3)
①曲线Ⅱ首先达到平衡状态,说明温度高。但温度高甲醇的含量低,这说明升高温度平衡显逆反应方向移动,所以正方应是放热反应,则曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ。② CO2(g)+3H2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
转化量(mol) x 3x x x
平衡量(mol) 1-x 3-3x x x
则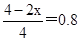
解得x=0.4
要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c>0.4。由于起始时CO2是1mol,所以甲醇的物质的量不能超过1.0mol。
③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.由于保持恒压,因此容器中压强不变不能说明反应达到平衡状态,a错误;b.H2的体积分数不变可以说明反应达到平衡状态,b正确;c.c(H2)=3c(CH3OH)不能说明正逆反应速率相等,所以不能说明反应达到平衡状态,c错误;d.密度是混合气的质量和容器容积的比值,在反应过程中质量不变,压强不变,则容器容积减小,所以当密度不变时可以说明反应达到平衡状态,d正确;e.2个C=O断裂的同时有6个H-H断裂均表示正反应速率,不能说明反应达到平衡状态,e错误,答案选bd。
(4)根据图像可知随着投料比[n(H2) / n(CO2)]的增大二甲醚的含量逐渐增大。又根据方程式可知投料比[n(H2) / n(CO2)]=3时二甲醚的含量最高,所以图像可表示为
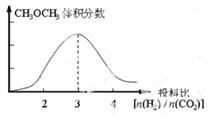 。 。
考点:考查盖斯定律、电化学、平衡状态计算与判断、外界条件对平衡状态的影响等
本题难度:困难
2、选择题 某温度下,在一个2L的密闭容器中,加入4mol A和2mol B发生反应:3A(g)+2B(g)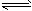 4C(s)+2D(g), 4C(s)+2D(g),
5min后达到平衡,测得生成1.6mol C,则下列说法正确的是 [???? ]
A.该反应的化学平衡常数表达式是K=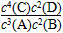
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.若向平衡体系中加入少量C,则正、逆反应速率均增大
参考答案:B
本题解析:
本题难度:一般
3、选择题 反应Cl2+H2O HCl+HClO达平衡时,欲使HClO浓度增大,应加入( ) HCl+HClO达平衡时,欲使HClO浓度增大,应加入( )
A.CaCO3
B.HCl
C.NaOH
D.H2O
参考答案:A
本题解析:A、CaCO3与HCl反应生成水和二氧化碳,降低盐酸的浓度,使平衡右移,HClO浓度增大;B、增大HCl浓度,平衡左移,故HClO浓度均减小;C、NaOH与HCl、HClO均发生中和反应,使HClO浓度减小;D、加水稀释,平衡右移,但HCl、HClO浓度均减小。故符合条件的只有A。
本题难度:一般
4、选择题 一定温度下,2SO2(g)+O2(g)?2SO3(g);△H=-197kJ/mol,将3molSO2和1molO2充入一定容密闭容器中,在催化剂存在下进行下列反应,当达到平衡状态时,下列说法中正确的是( )
A.生成SO3为2mol
B.SO3和SO2物质的量之和一定为3mol
C.放出197kJ的热量
D.SO2的物质的量和SO3物质的量一定相等
参考答案:A、该反应为可逆反应,1mol氧气完全反应才能生成2mol二
本题解析:
本题难度:一般
5、填空题 为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+ O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。 2NO(g),是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+ O2(g) 2NO(g)的△H__________0(填“>”或“<”)。 2NO(g)的△H__________0(填“>”或“<”)。

②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
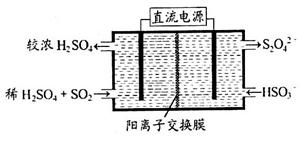
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)以H2O2和硼氢化合物NaBH4(B的化合价为+3价)作原料的燃 料电池,可用作电解池的电源。其工作原理如图所示
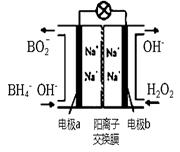
①写出a极上的电极反应式: ,
②正极材料采用MnO2,MnO2除了作电极材料之外还可能具有的作用为
参考答案:(1)① > (1分) &
本题解析:
本题难度:困难
|
|
网站客服QQ: 960335752 - 14613519 - 791315772