微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知热化学方程式H2 (g) + F2 (g) ="==" 2 HF (g) △H = -270 kJ· mol-1,下列说法中错误的是
A.在上述条件下,44.8 L氟化氢气体分解成22.4 L氢气与22.4 L氟气吸收270 kJ热量
B.在上述条件下,1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出热量大于270 kJ
C.在上述条件下,1 mol氢气与 1 mol氟气的能量总和大于 2 mol氟化氢气体的能量
D.上述热化学方程式还可表示为:1/2 H2 (g) +1/2 F2 (g)="==" HF (g) △H = -135 kJ· mol-1
参考答案:A
本题解析:
试题分析:A项:吸收的能量应为270KJ*2=540KJ,故错。故选A。
考点:化学反应与能量
点评:本题考查的是化学反应与能量的相关计算,题目难度不大,解得本题需要注意的是吸收的能量与化学计量呈正比的关系。
本题难度:简单
2、填空题 (14分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
1.在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
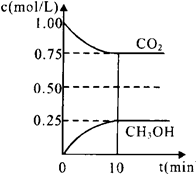
①能说明该反应已达平衡状态的是________。
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②下列措施中能使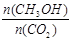 增大的是________(选填编号)。
增大的是________(选填编号)。
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=_________。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
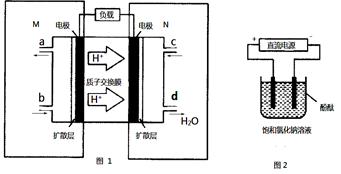
①M区发生反应的电极反应式为______________________ _________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解反应的总反应的离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:________________________ _________。
参考答案:(1)①AB
本题解析:
试题解析:(1)①未平衡CO2的体积分数是个变化的量,现在混合气体CO2的体积分数保持不变,说明已经平衡了,故A正确;未平衡时混合气体的平均相对分子质量是个变化的量,现在不随时间的变化而变化,说明已经达平衡状态,故B正确;单位时间内每消耗1.2mol H2,向正方向,同时生成0.4mol H2O,也向正方向,不能反映正逆反应之间的关系,故C错误;反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变,不能说明各自的量不再随时间的变化而变化,故C错误;②升高温度,平衡逆向移动,故比值减小,故A错误;恒温恒容下充入He(g),平衡不移动,故比值不变,故B错误;将H2O(g)从体系中分离,平衡正向移动,故比值变大,故C正确;恒温恒容再充入2mol CO2和3mol H2,相当于增大压强,平衡正向移动,故比值变大,故D正确;
③CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始(mol/L) 1 1.5 0 0
变化(mol/L) 0.25 0.75 0.25 0.25
平衡(mol/L) 0.75 0.75 0.25 0.25
所以: K=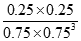 =0.20,而平衡常数是温度的函数,只有通过改变温度,来改变平衡常数,正反应量放热反应,降低温度,K值变大;(2)①M区是质子流出的一极,应是原电池的负极,发生氧化反应,电极反应式为:CH3OH-6e-+H2O=CO2+6H+;②用惰性电极,电解饱和食盐水总的电极反应式为2Cl-+2H2O
=0.20,而平衡常数是温度的函数,只有通过改变温度,来改变平衡常数,正反应量放热反应,降低温度,K值变大;(2)①M区是质子流出的一极,应是原电池的负极,发生氧化反应,电极反应式为:CH3OH-6e-+H2O=CO2+6H+;②用惰性电极,电解饱和食盐水总的电极反应式为2Cl-+2H2O H2↑+Cl2↑+2OH-,pH值变为13时,pOH=1,C(OH-)=10-1mol/L,n(OH-)=10-1mol/L×300mL×10-3L/mL=0.03mol,由CH3OH-6e-+H2O=CO2+6H+,2Cl-+2H2O
H2↑+Cl2↑+2OH-,pH值变为13时,pOH=1,C(OH-)=10-1mol/L,n(OH-)=10-1mol/L×300mL×10-3L/mL=0.03mol,由CH3OH-6e-+H2O=CO2+6H+,2Cl-+2H2O H2↑+Cl2↑+2OH-可知:
H2↑+Cl2↑+2OH-可知:
CH3OH ~ 6e- ~ 6OH-
32g 6mol
m(CH3OH) 0.03mol
则m(CH3OH)=32g×0.03mol÷6mol=0.16g;
(3)应用盖斯定律解题,△H=-△H1-△H2+ △H3+2△H4=-(
△H3+2△H4=-( c+2d-a-b)kJ?mol-1,所以CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+
c+2d-a-b)kJ?mol-1,所以CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+ O2(g)=CO2(g)+2H2O(l)△H=-(
O2(g)=CO2(g)+2H2O(l)△H=-( c+2d-a-b)kJ?mol-1。
c+2d-a-b)kJ?mol-1。
考点:化学反应中的能量变化、化学平衡、电化学
本题难度:一般
3、选择题 下列离子方程式与所述事实相符且正确的是
A.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO4-恰好沉淀完全:2Al3++3S+3Ba2++6OH-═2Al(OH)3↓+3BaSO4
B.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3═Fe+3Cl-+H2O+H+
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO
D.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3++OH-═CaCO3↓+H2O
参考答案:D
本题解析:分析:A、向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO4-恰好沉淀完全,按照1:2反应,结合离子性质分析写出;
B、强碱溶液中不能生成氢离子;
C、过量二氧化碳生成碳酸氢根离子;
D、同种金属的酸式盐和碱反应生成盐和水;
解答:A、向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO4-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O,故A错误;
B、强碱溶液中不能生成氢离子,故B错误;
C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;故C错误;
D、Ca(HCO3)2与过量Ca(OH)2溶液反应,碳酸氢钙全部反应:Ca2++HCO3-+OH-═CaCO3↓+H2O,故D正确;
故选D.
点评:本题考查了离子方程式的书写方法和注意问题,量不同产物不同,掌握离子性质间的反应是解题关键,题目难度中等.
本题难度:简单
4、选择题 下列反应中盐酸既表现出酸性有表现出氧化性的是
A.MnO2+4HCl(浓)MnCl2+Cl2↑+H2O
B.HCl+AgNO3=AgCl↓+HNO3
C.Zn+2HCl=ZnCl2+H2↑
D.2HClH2↑+Cl2↑
参考答案:C
本题解析:分析:盐酸表现出酸性,应生成对应的氯化物,表现出氧化性,应被还原生成氢气,以此解答该题.
解答:A.反应中Cl化合价升高,被氧化,盐酸表现出还原性,故A错误;
B.反应为复分解反应,化合价没有变化,不是氧化还原反应,故B错误;
C.生成氢气,盐酸表现出氧化性,生成氯化锌,盐酸表现出酸性,故C正确;
D.分解时H盐酸的化合价降低,Cl元素的化合价升高,盐酸既表现出氧化性,又表现出还原性,故D错误.
故选C.
点评:本题考查氧化还原反应知识,题目难度不大,注意从化合价变化的角度分析,盐酸表现出酸性时,生成盐.
本题难度:简单
5、选择题 已知:①lmolH分子中化学键断裂时需要吸收436 kJ的能量②1molCl分子中化学键断裂时需要吸收243kJ的能量③由H原子和Cl原子形成l mol HCl分子时释放431 kJ的能量下列叙述中正确的是 [???? ]
A.氢气和氯气反应生成氯化氢气体的热化学方程式是: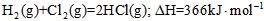
B.氢气和氯气反应生成2 mol氯化氢气体,反应的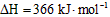
C.氢气和氯气反应生成2mol氯化氢气体,反应的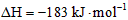
D.氢气和氯气反应生成1 mol氯化氢气气体,反应的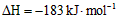
参考答案:C
本题解析:
本题难度:一般