微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿仑尼乌斯(Arrhenius)提出了的电离理论。
(1)1905年富兰克林(Franklin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。试写出液氨自身弱电离的方程式:____________________。
(2)1923年丹麦化学家布朗斯物(Brusted)和英国化学家劳莱(Lowry)提出了质子论。凡是能够释放质子 (氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论:下列粒子在水溶液中既可看作酸又可看作碱的是__________。
A.H2O B.NH4+ C.OH- D.HCO3- E.CH3COO- F.Cl-
(3)1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是 能和电子对结合的物质都是酸。如:酸(电子对接受体)碱(电子对给予体)反应产物
H+ + [:OH]-→ H:OH 试指出下列两个反应中的酸或碱:
H3BO3+H2O=H++B(OH)4- 该反应中的碱是____(填“H3BO3”或“H2O”)
NaH+H2O=NaOH+H2↑ 该反应中的酸是____(填“NaH”或“H2O”)
2、选择题 常温?下,0.1mol/L氨水中c(H+)/c(OH-)=1×10-10,下列说法正确的是 [???? ]
A.溶液中由水电离出的c(OH-)=1×10-10 mol/L
B.溶液中c(OH-)+c(NH3·H2O)=0.1mol/L
C.与0.1mol/L?的盐酸等体积混合后所得溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)=0.1mol/L
D.原溶液中加入少量的氯化铵晶体或加水稀释,溶液中的c(H+)均增大
3、选择题 浓度为0.1mol/L的某物质的水溶液,且PH=5.1,则此物质应是下列中的[???? ]
A.H2SO4
B.NH4Cl
C.NaHCO3
D.CH3COONa
4、选择题 已知0.1mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是[???? ]
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:[Na-]+[H-]=[HA+]+[OH-]+2[A2-]
D.在Na2A溶液中一定有:[Na+]>[A2-]> [H+]>[OH-]
5、选择题 物质的量浓度相同的下列溶液中,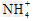 浓度最大的是 [???? ]
浓度最大的是 [???? ]
A.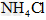 ??????????
??????????
B.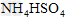 ??????????
??????????
C. ????????
????????
D.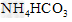 ?
?